- Forschungsgruppenleiterin
- Core Managerin
- Mauspathologie Facility
Forschungsprofile
Projekte
Funktion der Mikroglia bei neurodegenerativen Erkrankungen
Nach jahrzehntelanger Fokussierung auf Neuronen bei neurodegenerativen Erkrankungen wurde immer deutlicher, dass auch andere Zellarten des Gehirns die Krankheitsprozesse aktiv beeinflussen. Mikroglia, die angeborenen Immunzellen des Gehirns, werden bei neurodegenerativen Erkrankungen stark aktiviert. Obwohl Mikroglia im gesunden Gehirn das Überleben der Neuronen unterstützen, werden sie während des Krankheitsverlaufs pro-inflammatorisch und tragen aktiv zum Verlust von Neuronen bei. Ich interessiere mich besonders für diesen Phänotypwechsel der Mikroglia und die Faktoren, die dazu beitragen (apoptotische Neuronen; aggregierte Proteine; Vesikel?). Kürzlich konnten wir einige Schlüsselproteine, darunter ApoE und Trem2, in der Kaskade von gesunden homöostatischen zu dysregulierten Mikroglia bei der Alzheimer-Krankheit identifizieren. Neue Forschungsergebnisse deuten darauf hin, dass ein fein abgestimmtes Gleichgewicht zwischen Homöostase und Aktivierung, aber nicht Überaktivierung, den optimalen Funktionszustand der Mikroglia bestimmen könnte. Die Erforschung der Details des phänotypischen Wechsels der Mikroglia verspricht, diese wichtigen Gehirnzellen als therapeutische Option zur Behandlung neurodegenerativer Erkrankungen wie der Alzheimer-Krankheit zu manipulieren.
Ausgewählte Publikationen
- Muth C, Hartmann A, Sepulveda-Falla D, Glatzel M, Krasemann S. Phagocytosis of Apoptotic Cells Is Specifically Upregulated in ApoE4 Expressing Microglia in vitro. (2019) Front Cell Neurosci.
DOI: 10.3389/fncel.2019.00181 - Krasemann S, Madore C, Cialic R, Baufeld C, Calcagno N, El Fatimy R, Beckers L, O'Loughlin E, Xu Y, Fanek Z, Greco DJ, Smith ST, Tweet G, Humulock Z, Zrzavy T, Conde-Sanroman P, Gacias M, Weng Z, Chen H, Tjon E, Mazaheri F, Hartmann K, Madi A, Ulrich JD, Glatzel M, Worthmann A, Heeren J, Budnik B, Lemere C, Ikezu T, Heppner FL, Litvak V, Holtzman DM, Lassmann H, Weiner HL, Ochando J, Haass C, Butovsky O. The TREM2-APOE Pathway Drives the Transcriptional Phenotype of Dysfunctional Microglia in Neurodegenerative Diseases. (2017) Immunity.
DOI: 10.1016/j.immuni.2017.08.008 - Mazaheri F, Snaidero N, Kleinberger G, Madore C, Daria A, Werner G, Krasemann S, Capell A, Trümbach D, Wurst W, Brunner B, Bultmann S, Tahirovic S, Kerschensteiner M, Misgeld T, Butovsky O, Haass C. TREM2 deficiency impairs chemotaxis and microglial responses to neuronal injury. (2017) EMBO Rep.
DOI: 10.15252/embr.201743922
Mikroglia bei Prionenkrankheiten
Prionenkrankheiten sind der Prototyp neurodegenerativer Krankheiten, bei denen es zur Fehlfaltung von Proteinen kommt. Die Tatsache, dass ein normales zelluläres Protein seine Konformation ändert und die Fähigkeit erlangt, sich selbst in einem stammähnlichen Muster zu vermehren, ist ein faszinierender Mechanismus, der meine Aufmerksamkeit schon sehr früh während meiner wissenschaftlichen Ausbildung weckte. Bemerkenswert ist, dass bei Prionenkrankheiten, bei denen wir eine massive Aktivierung der Mikroglia feststellen, mehrere bekannte Proteine, wie ApoE oder Trem2, keine Rolle spielen. Die Rolle der Mikroglia in der Pathophysiologie der Prionenkrankheiten ist immer noch unklar. Mikroglia können bei der Beseitigung von Prionenaggregaten helfen, aber sie tragen auch zum Verlust der Gewebehomöostase bei und führen zu einem entzündungsfördernden und funktionsunfähigen Zustand. Hier wollen wir die gegensätzlichen Funktionen der Mikroglia bei Prionenerkrankungen genauer untersuchen.
Ausgewählte Publikationen
- Hartmann K, Sepulveda-Falla D, Rose IVL, Madore C, Muth C, Matschke J, Butovsky O, Liddelow S, Glatzel M, Krasemann S. Complement 3+-astrocytes are highly abundant in prion diseases, but their abolishment led to an accelerated disease course and early dysregulation of microglia. (2019) Acta Neuropathol Commun.
DOI: 10.1186/s40478-019-0735-1 - Muth C, Schröck K, Madore C, Hartmann K, Fanek Z, Butovsky O, Glatzel M, Krasemann S. Activation of microglia by retroviral infection correlates with transient clearance of prions from the brain but does not change incubation time. (2017) Brain Pathol.
DOI: 10.1111/bpa.12441 - Falker C, Hartmann A, Guett I, Dohler F, Altmeppen H, Betzel C, Schubert R, Thurm D, Wegwitz F, Joshi P, Verderio C, Krasemann S*, Glatzel M*. Exosomal cellular prion protein drives fibrillization of amyloid beta and counteracts amyloid beta-mediated neurotoxicity. (2016) J Neurochem.
DOI: 10.1111/jnc.13514
SARS-CoV-2 und die Pathologie von COVID-19
Das neuartige Coronavirus SARS-CoV 2 hat zu einer weltweiten Pandemie geführt. Infizierte Menschen erkranken an COVID-19 und zeigen Fieber, Durchfall, Müdigkeit und Husten. Aber auch neurologische Funktionsstörungen wie Geruchs- und Geschmacksverlust, aber auch Krampfanfälle und Schlaganfälle gehören zu den Symptomen. Überlebende leiden häufig unter neurologischen Erscheinungen wie Schwindel, Kopfschmerzen, Bewusstseinsstörungen, zerebrovaskulären Erkrankungen, Ataxie und Krampfanfällen, Sehstörungen und Nervenschmerzen, insbesondere bei Patienten mit schwerem Krankheitsverlauf. Um diese neurologischen Komplikationen zu verstehen, haben wir bereits im Frühjahr 2020 damit begonnen, die Häufigkeit und Verteilung von SARS-CoV-2 im Gehirn zu untersuchen. Wir haben festgestellt, dass der Nachweis von SARS-CoV-2 in Gewebeproben nicht trivial und anfällig für Fehlinterpretationen ist. Daher haben wir eine systematische Auswertung erstellt und den Arbeitsablauf optimiert. Jetzt nutzen wir unser Wissen und unsere Erfahrung, um mehrere klinisch relevante Fragen in der COVID-19-Forschung zu beantworten.
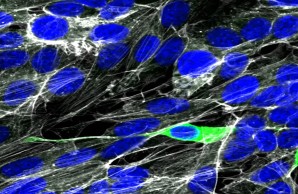
Menschliche neuronale Kulturzellen können in vitro mit SARS-CoV-2 infiziert werden. Ob und wie sich SARS-CoV-2 in COVID-19 auf das Gehirn ausbreitet, ist jedoch noch sehr umstritten. SARS-CoV-2-Nukleoprotein (grün), Aktin (weiß), Zellkerne (DAPI, blau).
Ausgewählte Publikationen
- Tallarek AC, Urbschat C, Fonseca Brito L, Stanelle-Bertram S, Krasemann S, Frascaroli G, Thiele K, Wieczorek A, Felber N, Lütgehetmann M, Markert UR, Hecher K, Brune W, Stahl F, Gabriel G, Diemert A, Arck PC. Inefficient Placental Virus Replication and Absence of Neonatal Cell-Specific Immunity Upon Sars-CoV-2 Infection During Pregnancy. (2021) Front Immunol.
DOI: 10.3389/fimmu.2021.698578 - Casagrande M, Fitzek A, Spitzer MS, Püschel K, Glatzel M, Krasemann S, Nörz D, Lütgehetmann M, Pfefferle S, Schultheiss M. Presence of SARS-CoV-2 RNA in the Cornea of Viremic Patients With COVID-19. (2021) JAMA Ophthalmol.
DOI: 10.1001/jamaophthalmol.2020.6339 - Matschke J, Lütgehetmann M, Hagel C, Sperhake JP, Schröder AS, Edler C, Mushumba H, Fitzek A, Allweiss L, Dandri M, Dottermusch M, Heinemann A, Pfefferle S, Schwabenland M, Sumner Magruder D, Bonn S, Prinz M, Gerloff C, Püschel K, Krasemann S, Aepfelbacher M, Glatzel M. Neuropathology of patients with COVID-19 in Germany: a post-mortem case series. (2020) Lancet Neurol.
DOI: 10.1016/S1474-4422(20)30308-2
Experimentelle Pathologie
Ich leite die Core Facility für experimentelle Pathologie "Maus Patho" des UKE. In dieser Funktion sind meine Mitarbeiterin Kristin Hartmann und ich bestrebt, qualitativ hochwertige histologische und immunhistochemische Färbungen von experimentellen und klinischen Geweben durchzuführen. Unsere Expertise in der gewebebasierten Untersuchung von viralen, metabolischen und neurodegenerativen Erkrankungen macht uns zu einem idealen Partner und führte auch zu unabhängigen Projekten. Unser besonderes Interesse gilt der Vielfalt und Aktivität von Immunzellen. Der Beitrag dieser Zellen zum Fortschreiten der Krankheit ist noch nicht vollständig geklärt, was zum Teil auf den Mangel an spezifischen Antikörpern und Nachweismethoden zurückzuführen ist. Unser umfassendes Fachwissen im Bereich der Färbung von Immunzellen, insbesondere bei schwer zu färbenden formalinfixierten, in Paraffin eingebetteten Geweben von Mäusen und Menschen, hat zu mehreren internen und internationalen Kooperationen geführt, die unsere Erfahrung weiter ausbauen.
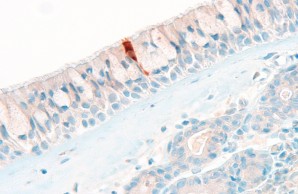
In our Core Facility we aim to visualize expression of health and disease relevant proteins in tissues in their spatial context. Here, a SARS-CoV-2 nucleoprotein positive cell in the respiratory epithelium in COVID-19 is shown.
Ausgewählte Publikationen
- Fernandez-Caggiano M, Kamynina A, Francois AA, Prysyazhna O, Eykyn TR, Krasemann S, Crespo-Leiro MG, Vieites MG, Bianchi K, Morales V, Domenech N, Eaton P. Mitochondrial pyruvate carrier abundance mediates pathological cardiac hypertrophy. (2020) Nat Metab.
DOI: 10.1038/s42255-020-00276-5 - Schaefer A, Schneeberger Y, Schulz S, Krasemann S, Werner T, Piasecki A, Höppner G, Müller C, Morhenn K, Lorenz K, Wieczorek D, Schwoerer AP, Eschenhagen T, Ehmke H, Reichenspurner H, Stenzig J, Cuello F. Analysis of fibrosis in control or pressure overloaded rat hearts after mechanical unloading by heterotopic heart transplantation. (2019) Sci Rep. 10.1038/s41598-019-42263-1.
DOI: 10.1038/s41598-019-42263-1 - Ricklefs FL, Alayo Q, Krenzlin H, Mahmoud AB, Speranza MC, Nakashima H, Hayes JL, Lee K, Balaj L, Passaro C, Rooj AK, Krasemann S, Carter BS, Chen CC, Steed T, Treiber J, Rodig S, Yang K, Nakano I, Lee H, Weissleder R, Breakefield XO, Godlewski J, Westphal M, Lamszus K, Freeman GJ, Bronisz A, Lawler SE, Chiocca EA. Immune evasion mediated by PD-L1 on glioblastoma-derived extracellular vesicles. (2018) Sci Adv.
DOI: 10.1126/sciadv.aar2766 - Pelczar P, Witkowski M, Perez LG, Kempski J, Hammel AG, Brockmann L, Kleinschmidt D, Wende S, Haueis C, Bedke T, Witkowski M, Krasemann S, Steurer S, Booth CJ, Busch P, König A, Rauch U, Benten D, Izbicki JR, Rösch T, Lohse AW, Strowig T, Gagliani N, Flavell RA, Huber S. A pathogenic role for T cell-derived IL-22BP in inflammatory bowel disease. (2016) Science.
DOI: 10.1126/science.aah5903