Arbeitsgruppen des Instituts
-
AG Virus Immunologie (Prof. Marcus Altfeld)
Mitarbeiter:innen
Prof. Marcus Altfeld, Silke Giesemann-Jansen, Heike Hildebrandt, Dr. Maria Pujantell Graell, Dr. Kati Tillack, Dr. Yulia Zhitnyuk
Forschungsprojekte
Our immune system defends us from environmental threats, such as bacterial and viral infections, and detects and removes abnormal cells that potentially lead to malignancies. Optimal immunological homeostasis is achieved when the threat (e.g. pathogen) is removed with the highest efficiency whilst avoiding collateral tissue damage for the host. Increasing scientific data, however, suggest that this immunological balance differs between women and men. It has been shown that women mount stronger immune responses against pathogens compared to men, leading to more rapid control or clearance of infections. Women also develop stronger immunity in response to vaccinations, and exhibit stronger immune responses against malignancies, including leukemia. Enhanced immune responsiveness in females, however, comes at a cost, including aggravated tissue damage, higher immune activation, persistent inflammation and significantly higher incidences of autoimmune diseases, such as autoimmune hepatitis and multiple sclerosis. However, the precise contribution of sex hormones and sex chromosome-encoded genes to sex-specific differences in immunity, and their relevance for human disease manifestations, remains insufficiently understood. The understanding of these mechanisms will pave the way for novel treatment strategies for infectious and immune-mediated diseases that take the sex of the affected individual into account.
FOR 5068 "Sex differences in Immunity"
Type I IFN-mediated sex differences in immune response to HIV-1
In acute HIV-1 infection, women control viral replication better than men. In contrast, women develop increased immune activation and faster loss of CD4+ T cells during untreated chronic HIV-1 infection. Increasing data indicate that these sex differences in the manifestation of HIV-1 disease are mediated by sex-specific differences in antiviral immunity. In previous studies we demonstrated that pDCs derived from women produce more IFNα in response to HIV-1 than pDCs from men, potentially contributing to the better control of viremia in acute infection. This increased IFNα production in response to HIV-1 however also led to significantly higher immune activation and faster loss of CD4+ T cells in chronically HIV-1-infected women. Taken together these data strongly suggest that sex differences in Type I IFN production result in differences in HIV-1 disease manifestations between women and men. However, the precise molecular mechanisms underlying these sex differences in HIV-1 and other infectious diseases remain poorly understood. We hypothesize that X chromosome-encoded genes play a critical role in regulating Type I IFN responses, and that gene-dose effects resulting from escape from X chromosome inactivation (XCI) contribute to sex-specific differences in antiviral immunity, using HIV-1 as a model. We will furthermore test the hypothesis that changes in levels of sex hormones can regulate Type I IFN responses of pDCs, using longitudinal samples from a human transgender cohort. Taken together, these studies will identify critical mechanisms underlying sex-specific differences in antiviral immunity, and provide rationale for the design of interventions that take these differences between women and men into account.
Forschungsnetzwerke
FOR 5068 Forschungsgruppe "Sex Differences in Immunity"
DZIF Deutsches Zentrum für Infektionsforschung
DZKJ Deutsches Zentrum für Kinder- und Jugendgesundheit
Ausgewählte Publikationen
Schloer S, Hennesen J, Rueschpler L, Zamzamy M, Flomm F, Ip WH, Pirosu A, Dobner T, Altfeld M. (2025) The host cell factor DDX3 mediates sex dimorphism in theIFNα response of plasmacytoid dendritic cells upon TLR activation. PharmacolRes.216:107764
Padoan B, Casar C, Krause J, Schultheiss C, Baumdick ME, Niehrs A, Zecher BF, Pujantell M, Yuki Y, Martin M, Remmerswaal EBM, Dekker T, van der Bom-Baylon ND, Noble JA, Carrington M, Bemelman FJ, van Lier RAW, Binder M, Gagliani N, Bunders MJ, Altfeld M. (2024) NKp44/HLA-DP-dependent regulation of CD8 effector T cells by NK cells. Cell Rep. 43:114089
Thiele RJ, Grünhagel B, Muenchhoff M, Pujantell-Graell M, Jocham L, Düsedau A, Hennesen J, Hildebrandt H, Hagen SH, Sandfort D, Bunders MJ, Keppler OT, Hoffmann C, Altfeld M. (2024) Magnitude of Type I Interferon Responses by Plasmacytoid Dendritic Cells After TLR7 Stimulation Is Associated With Human Immunodeficiency Virus Type 1 (HIV-1) Reservoir Sizes in Cisgender Women With HIV-1 on Antiretroviral Therapy. J Infect Dis. 229:1781-1785
Pujantell M, Skenteris NT, Claussen JM, Grünhagel B, Thiele RJ, Altfeld M. (2023) Sex-dependent differences in type I IFN-induced natural killer cell activation. Front Immunol.14:1277967.
Grünhagel B, Borggrewe M, Hagen SH, Ziegler SM, Henseling F, Glau L, Thiele RJ, Pujantell M, Sivayoganathan V, Padoan B, Claussen JM, Düsedau A, Hennesen J, Bunders MJ, Bonn S, Tolosa E, Krebs CF, Dorn C, Altfeld M. (2023) Reduction of IFN-I responses by plasmacytoid dendritic cells in a longitudinal trans men cohort. iScience. ;26:108209.
Naidoo K, Altfeld M. (2023) SARS-CoV-2 exploits innate miscommunication forpersistence. Nat Immunol. 24:1974-1975
Zecher BF, Ellinghaus D, Schloer S, Niehrs A, Padoan B, Baumdick ME, Yuki Y, Martin MP, Glow D, Schröder-Schwarz J, Niersch J, Brias S, Müller LM, Habermann R, Kretschmer P, Früh T, Dänekas J, Wehmeyer MH, Poch T, Sebode M; International PSC Study Group (IPSCSG); Ellinghaus E, Degenhardt F, Körner C, Hoelzemer A, Fehse B, Oldhafer KJ, Schumacher U, Sauter G, Carrington M, Franke A, Bunders MJ, Schramm C, Altfeld M. (2024) HLA DPA1*02:01~B1*01:01 is a risk haplotype for primary sclerosing cholangitis mediating activation of NKp44+ NK cells. Gut. 73:325-337.
Baumdick ME, Niehrs A, Degenhardt F, Schwerk M, Hinrichs O, Jordan-Paiz A, Padoan B, Wegner LHM, Schloer S, Zecher BF, Malsy J, Joshi VR, Illig C, Schröder-Schwarz J, Möller KJ; Hamburg Intestinal Tissue Study Group; Martin MP, Yuki Y, Ozawa M, Sauter J, Schmidt AH, Perez D, Giannou AD, Carrington M, Davis RS, Schumacher U, Sauter G, Huber S, Puelles VG, Melling N, Franke A; International Inflammatory Bowel Disease Genetics Consortium; Altfeld M, Bunders MJ. (2023) HLA-DP on Epithelial Cells Enables Tissue Damage by NKp44+ Natural Killer Cells in Ulcerative Colitis. Gastroenterology. 165:946-962.e13.
Hagemann K, Riecken K, Jung JM, Hildebrandt H, Menzel S, Bunders MJ, Fehse B, Koch-Nolte F, Heinrich F, Peine S, Schulze Zur Wiesch J, Brehm TT, Addo MM, Lütgehetmann M, Altfeld M. (2022) Natural killer cell-mediated ADCC in SARS-CoV-2-infected individuals and vaccine recipients. Eur J Immunol. 52:1297-1307
Koyro TF, Kraus E, Lunemann S, Hölzemer A, Wulf S, Jung J, Fittje P, Henseling F, Körner C, Huber TB, Grundhoff A, Wiech T, Panzer U, Fischer N, Altfeld M. (2021) Upregulation of HLA-F expression by BK polyomavirus infection induces immune recognition by KIR3DS1-positive natural killer cells. Kidney Int. 99:1140-1148
Hagen SH, Florian Henseling, Hennesen J, Savel H, Delahaye S, Richert L, Ziegler SM, Altfeld M. (2020) Heterogeneous Escape from X Chromosome Inactivation Results in Sex Differences in Type I IFN Responses at the Single Human pDC Level. Cell Rep 33:108485
-
AG Infektionsbiologie (Prof. Hans-Willi Mittrücker)
Mitarbeiter:innen
Prof. Dr. Hans-Willi Mittrücker, Melina Birus, Peter Bradtke, Nameeta Jesudoss Manalan, Dr. Friederike Raczkowski, Jonas Rösch, Joanna Schmid, Dennis Yüzen
Forschungsprojekte
T-Zellen spielen eine zentrale Rolle in Immunantworten gegen Pathogene, sie sind aber auch entscheidend für die Entstehung von Autoimmunerkrankungen. In unserer Arbeitsgruppe verwenden wir verschiedene Mausmodelle für bakterielle Infektionen und für Autoimmunerkrankungen der Niere um die Funktion und Regulation von T-Zellen zu untersuchen.
Schwerpunkte sind:
● Die Funktion und Regulation von CD4 und CD8 T-Zellen in Infektionen mit bakterielen Pathogenen. Die Analysen finden in Infektionsmodellen für Listeria monocytogenes, Staphylococcus aureus und Salmonella typhimurium statt.
● Die Rolle des Transkriptionsfaktors Interferon Regulatory Factor 4 (IRF4) in der Aktivierung und Differenzierung von T-Zellen.
● Die Regulation der T-Zellantwort durch den IL-6 Rezeptor.
● Autoimmune Nierenerkrankungen und die Rolle von T-Zellen in der Entstehung und Aufrechterhaltung von Immunreaktionen gegen glomeruläre Strukturen.
● Die Bedeutung von durch Adenenin-Nukleotide aktivierbarer Ca2+ Kanäle in T-Zellen.
Forschungsnetzwerke
DFG: SFB 1328 “Adenine Nucleotides in Immunity and Inflammation” (A03: “Adenine nucleotide-modulated T cell differentiation and effector Functions”, Prof. H.-W. Mittrücker, Prof. Samuel Huber)
DFG: SFB 1192 „Immune-mediated glomerular diseases” (A4: “Autoreactive T cell responses in glomerulonephritis”)
DFG: KFO 296 „Feto-maternal immune cross talk: Consequences for maternal and offspring’s health” (P2 "Identification of viral determinants and maternal immune responses underlying influenza A virus disease severity during pregnancy“, Prof. G. Gabriel, Prof. H.-W. Mittrücker, Prof. P. Arck).
Ausgewählte Publikationen
Harberts A, Schmidt C, Schmid J, Reimers D, Koch-Nolte F, Mittrücker H-W*, Raczkowski F*. Interferon Regulatory Factor 4 controls effector functions of CD8+ memory T cells. (2021) Proc Natl Acad Sci USA. 118:e2014553118. (*shared last authorship)
Krebs CF, Reimers D, Zhao Y, Paust HJ, Bartsch P, Nuñez S, Rosemblatt MV, Hellmig M, Kilian C, Borchers A, Enk LUB, Zinke M, Becker M, Schmid J, Klinge S, Wong MN, Puelles VG, Schmidt C, Bertram T, Stumpf N, Hoxha E, Meyer-Schwesinger C, Lindenmeyer MT, Cohen CD, Rink M, Kurts C, Franzenburg S, Koch-Nolte F, Turner JE, Riedel JH, Huber S, Gagliani N, Huber TB, Wiech T, Rohde H, Bono MR, Bonn S, Panzer U*, Mittrücker H-W*. (2020) Pathogen-induced tissue-resident memory TH17 (TRM17) cells amplify autoimmune kidney disease. Sci Immunol. 5:eaba4163. (*shared last authorship)
Klinge S, Yan K, Reimers D, Brede KM, Schmid J, Paust HJ, Krebs CF, Panzer U, Hopfer H, Mittrücker H-W. (2019) Role of regulatory T cells in experimental autoimmune glomerulonephritis. Am J Physiol Renal Physiol. 316:F572-F581.
Mahnke J, Schumacher V, Ahrens S, Käding N, Feldhoff LM, Huber M, Rupp J, Raczkowski F, Mittrücker H-W. (2016) Interferon Regulatory Factor 4 controls TH1 cell effector function and metabolism. Sci Rep. 6:35521.
Hünemörder S, Treder J, Ahrens S, Schumacher V, Paust H-J, Menter T, Matthys P, Kamradt T, Meyer-Schwesinger C, Panzer U, Hopfer H, Mittrücker H-W. (2015) TH1 and TH17 cells promote crescent formation in experimental autoimmune glomerulonephritis. J Pathol. 237:62-71.
Raczkowski F, Ritter J, Heesch K, Schumacher V, Höcker L, Raifer H, Klein M, Bopp T, Harb H, Kesper DA, Pfefferle PI, Grusdat M, Lang PA, Mittrücker H-W*, Huber M*. (2013) The transcription factor Interferon Regulatory Factor 4 is required for the generation of protective effector CD8+ T cells. Proc Natl Acad Sci USA. 110:15019-15024. (*shared last authorship)
Mittrücker H-W, Steinhoff U, Köhler A, Krause M, Lazar D, Mex P, Miekley D, Kaufmann SHE. (2007) Poor correlation between BCG vaccination-induced T cell responses and protection against tuberculosis. Proc Natl Acad Sci USA. 104:12434-12439.
Kursar M, Höpken UE, Koch M, Köhler A, Lipp M, Kaufmann SHE, Mittrücker H-W. (2005) Differential requirements for the chemokine receptor CCR7 in T-cell activation during Listeria monocytogenes infection. J Exp Med. 201:1447-1457.
Kursar M, Bonhagen K, Fensterle J, Köhler A, Hurwitz R, Kamradt T, Kaufmann SHE, Mittrücker H-W. (2002) Regulatory CD4+ CD25+ T cells restrict memory CD8+ T cell responses. J Exp Med. 196:1585-1592.
Mittrücker H-W, Matsuyama T, Grossman A, Kündig TM, Potter J, Shahinian A, Wakeham A, Patterson B, Ohashi PS, Mak TW. (1997) Requirement for the transcription factor LSIRF/IRF4 for mature B and T lymphocyte function. Science. 275:540-543.
Kooperationspartner
Universitätsklinikum Hamburg-Eppendorf
Marcus Altfeld, Friedrich Koch-Nolte, Friedrich Haag, Eva Tolosa Institut für Immunologie Ulf Panzer, Christian Krebs, Oliver Steinmetz, Nicola Tomas, Elion Hoxha, Rolf Stahl III. Medizinische Klinik Samuel Huber, Nicola Gagliani, Peter Hübener I. Medizinische Klinik Petra Arck Geburtshilfe und Pränatalmedizin Gisa Tiegs Experimentelle Immunologie und Hepatologie Andreas Guse, Björn-Philipp Dierks Biochemie und Molekulare Zellbiologie Tim Magnus, Björn Rissiek Klinik für Neurologie Cathy Meyer-Schwesinger Institut für Physiologie Manuel Friese Institut für Neuroimmunologie und Multiple Sklerose
Externe Partner
Helmut Hopfer Universitätsspital Basel Minka Breloer, Hanna Lotter Bernhard-Nocht Institut für Tropenmedizin, Hamburg Magdalena Huber, Ulrich Steinhoff, Michael Lohoff Philipps-Universität Marburg Dirk Schmidt-Arras, Stefan Rose-John Christian-Albrechts Universität Kiel Santina Bruzzone University of Genova, Italy Gülsah Gabriel Leibniz Institute for Experimental Virology, Hamburg
Dissertationen
2021
Justus Mahnke (Dr. Med.) Der Transkriptionsfaktor Interferon Regulatory Factor 4 kontrolliert die Effektorfunktion und den Metabolismus von TH1-Zellen
Lucas Schumacher (Dr. Med.) Characterisation of single domain antibodies against the ADP-ribosylating Clostridium difficile toxin CDT and establishment of a murine infection model with the pathogen.
2019
Moritz Link (Dr. Med.) Die Bedeutung von ADAM17 für die TH1 und CD8 T-Zellantwort gegen bakterielle Krankheitserreger
Daniel Reimers (Dr. rer nat.) Der Einfluss von bakteriell induzierten geweberesidenten T-Zellen auf renale Autoimmunerkrankungen
2018
Alexandra Maximiliane Hierweger (Dr. rer. biol. hum. / PhD) Influence of influenza A virus infections on the maternal immune system during pregnancy
2017
Jule Gehrke (Master Infection Biology) The influence of TRPM2 on the CD8+ T‐cell response to Listeria monocytogenes
Karsten Yan (geb. Lücke) (Dr. rer nat.) Einfluss von IL‐6 auf die angeborene Immunantwort der Maus gegen Listeria monocytogenes
2016
Stefanie Klinge (geb. Ahrens) (Dr. rer. nat.) Die Rolle von regulatorischen T-Zellen in der autoimmunen anti-glomerulären Basalmembran-Glomerulonephritis
Kristina Broder (Dr. Med.) Die Regulation von CD8+ T-Zellen durch den Transkriptionsfaktor Interferon Regulatory Factor 4 (IRF4)
-
AG Molekulare Immunologie (Prof. Friedrich Koch-Nolte)
Mitarbeiter:innen
Prof. Friedrich Koch-Nolte, Dr. rer. nat. Anna Marei Mann, Dr. rer. nat. Julia Hambach, Marten Dannenberg, Anya Duttmann, Samantha Eiberg, Josephine Gebhardt, Saruul Jargalsaikhan, Luca Pape, Nathalie Richter, Henry Risch, Waldemar Schäfer, Alessa Schaffrath, Fabienne Seyfried, Natalie Tode
Forschungsprojekte
Die Arbeitsgruppe Molekulare Immunologie untersucht membranständige Rezeptoren und Enzyme von Immun- und Krebszellen und entwickelt Nanobodies und Antikörper gegen diese Zielstrukturen.
Forschungsnetzwerke
DFG: SFB 1192 „Immune-mediated glomerular diseases” (B05: Nanobody basierte Behandlungsstrategien bei Glomerulonephritiden, Nicola Wanner, Friedrich Nolte)
DFG: SFB 1328 “Adenine Nucleotides in Immunity and Inflammation” (A10: Rolle von Adenin-Nukleotiden und purinergen Rezeptoren im Fettgewebe, Jörg Heeren, Friedrich Nolte; Z02: Antikörper und Nanobodies für die Erforschung und Modulation des Adenin-Nukleotid-Signalings Friedrich Haag, Friedrich Nolte)
DFG: FOR 2879 "ImmunoStroke: From Immune Cells to Stroke Recovery" (A1: Die Rolle von ATP und NAD als Gefahrensignale und Therapieziel in der Erholungsphase des Schlaganfalles, Tim Magnus, Friedrich Nolte)
DFG/ANR: Evaluierung von P2X7 als therapeutisches Target in der Autoimmun-Enzephalitis und in der Tumorabwehr (Sahil Adriouch, Univ. Rouen, Friedrich Nolte)
DFG: Entwicklung von Nanobody-basierten bispezifischen Diabodies und Schwereketten-Antikörper für das gezielte Targeting von Myelomzellen (Peter Bannas, Radiologie, Friedrich Nolte)
BMBF COMMUTE Combinatorial and multidisciplinary targeting of effective gene therapy vectors (P5 Targeting glioblastoma and muscle dystrophy with Nanobody-displaying AAV, Friedrich Nolte)
Short CV Prof. Friedrich Koch-Nolte
Deputy Director (since 1997)
Phone: +49 (0) 40 7410 - 53612
Mail: nolte@uke.deUniversity Degrees
Biology, Wesleyan University 1976 (BA)
Medicine, University of Tübingen, 1983 (MD)
Molceular Biology, University of Hamburg, 1986 (Diploma)
Professor associée at the University of Rouen, France (2006-2007)
Visiting scientist at the University of California, San Francisco, CA, USA (1994)
Visiting scientist at the DNAX Research Institute of Molecular Biology, Palo Alto, CA, USA (1997)
Visiting scientist at The Jackson Lab, Bar Harbor, ME, USA (1991, 1999)
Forschungspreis der Hamburger Krebsgesellschaft (2019)Mentorship Award of the Simon-Claussen Foundation (2009)
Research Award of the Werner Otto Foundation (1997)
Research Award of the Martini Foundation (1991)
Member of the
Deutsche Gesellschaft für Immunologie (DGfI)
Deutsche Gesellschaft für Biochemie und Molekularbiologie (GBM)
Deutsche Gesellschaft für Zellbiologie (DGZ)Kooperationspartner
Universitätsklinikum Hamburg-Eppendorf
Friedrich Haag, Eva Tolosa, Hans-Willi Mittrücker Institut für Immunologie Andreas Guse, Jörg Heeren, Ralf Fliegert Biochemie und Molekulare Zellbiologie Peter Bannas Klinik für Radiologie Tim Magnus, Björn Rissiek Klinik für Neurologie Cathy Meyer-Schwesinger Institut für Physiologie Nicola Wanner, Nicola Tomas, Elion Hoxha, Rolf Stahl, Ulf Panzer III. Medizinische Klinik Boris Fehse, Kristoffer Rieken Experimentelle Immunologie und Hepatologie Irm Hermanns Borgmeyer Zentrum für Molekulare Neurobiologie Katja Weisel, Walter Fiedler I. Medizinische Klinik Thomas Braulke Kinderbiochemie
Externe Partner
Sahil Adriouch Universität Rouen Michael Hottiger Universität Zürich Pablo Pelegrin Universiät Murcia Mascha Binder Universiät Halle Martin Trepel Universiät Augsburg Dirk Grimm Universiät Heidelberg Annette Nicke Ludwig-Maximilians-Universität München Carsten Watzl Universiät Dortmund Florian Schmidt Universität Bonn Francesco Di Virgilio, Elena Adinolfi Universiät Ferrara Santina Bruzzone, Paolo Malatesta Universiät Genua Jan van Lier Universiät Amsterdam Jaime Sancho Universiät Granada Pablo Engel Universiät Barcelona Ursula Dietrich Georg-Speyer-Haus William Heath Universiät Melbourne William Petri Universiät Virginia Steven Mansoor Universiät Oregon Hidde Ploegh Boston Children's Hospital
Research Interests
The focus of our laboratory is on the molecular characterization of lymphocyte membrane proteins, in particular receptors and enzymes involved in signaling by extracellular nucleotides. We generate monoclonal and single domain antibodies as new research and therapeutic tools. We are interested in ADP-ribosylation as a pathogenic mechanism of bacterial toxins and as a reversible posttranslational modification regulating protein functions. Using genetic immunization and antibody engineering, we strive to develop new tools for combating infections and for treating diseases of the immune system.
1. Lymphocyte membrane proteins: enzymes and receptors involved in signaling by extracellular NAD and ATP
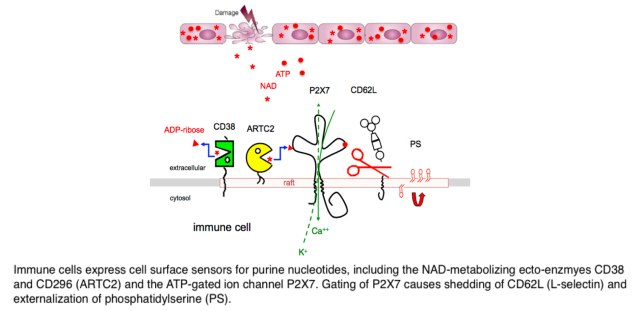
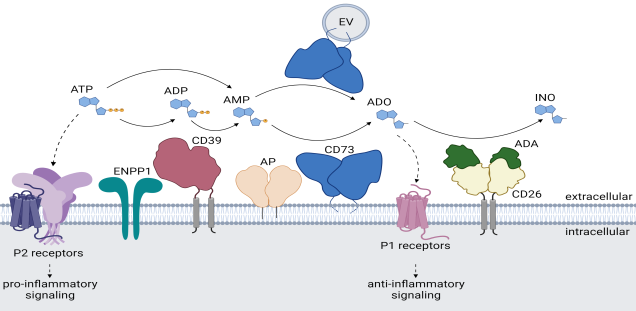
Membrane proteins mediate the communication of cells with their environment. They function as receptors for soluble ligands and counter-receptors on other cells, as ion channels, nutrient transporters, and enzymes. The nucleotides NAD and ATP are key metabolites of energy metabolism found in cells from all kingdoms of life. The cell membrane is impermeable to these nucleotides, but they can exit cells via channels or pores gated by mechanical and/or electrical stimuli. During infection and inflammation injured cells release NAD and ATP through the damaged cell membrane. Extracellular NAD and ATP alert cells of the immune system to sites of tissue damage.Cells of the immune system are equipped with a variety of sensors for these nucleotides (Fig. 1), including ligand-gated ion channels (P2X purine receptors) and nucleotide-metabolizing ecto-enzymes (CD38, CD296). CD296 (ARTs) functions as NAD-sensors and relay information about the levels of extracellular NAD into ADP-ribosylation of cell surface and secreted proteins. The NAD-hydrolyzing ecto-enzyme CD38 restricts the intensity and duration of NAD-signaling in the extracellular space by hydrolyzing NAD. Opening of the P2X7 ion channel is induced by binding of the soluble ligand ATP, or by NAD-dependent ADP-ribosylation. Passage of ions through P2X7 (calcium into the cell, potassium out of the cell) triggers a cascade of downstream events, including protease activation (caspases and ADAMs), externalization of phosphatidylserine (PS), activation of the inflammasome and cell death. Mice that cannot express the mentioned purine receptors or ecto-enzymes show impaired immune responses. The receptors and enzymes of purinergic signaling, thus, present potential targets for new anti-inflammatory or immune-stimulating drugs. In mouse models, activating the ARTC2 > P2X7 axis can enhance anti-tumor responses, while blocking this axis can reduce inflammation in autoimmune diseases.
2. Antibody engineering: genetic immunization, single domain antibodies
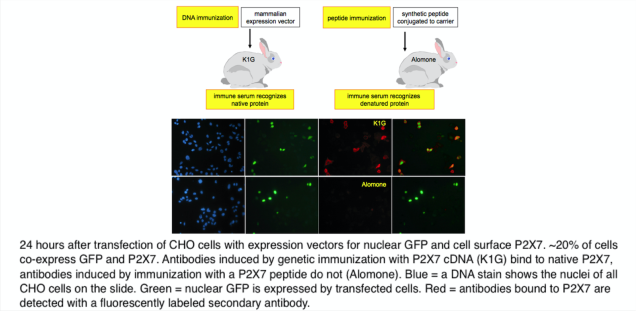
Antibodies are important tools of research, diagnosis and therapy. Antibodies are raised by immunizing experimental animals with proteins, synthetic peptides, or DNA. In the case of DNA immunizations, the protein encoded by the DNA is produced in its native conformation by the cells of the immunized animal and the induced immune response yields antibodies directed against proteins in native conformation (ADAPINCs) (Fig. 2). Such antibodies are useful in many applications were anti-peptide antibodies fail, e.g. affinity purification, flow cytometry, ELISA, FACS, and functional studies. cDNA immunization is offered as a service via the antibody core facility of the UKE.
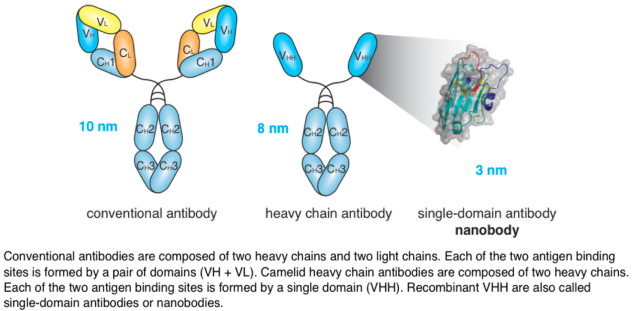
Llamas produce unusual antibodies composed only of heavy chains. Their antigen-binding domain (VHH) is readily produced as a soluble recombinant protein, also designated nanobody or single domain antibody (sdAb) (Fig. 3). Nanobodies can form finger like extrusions that block clefts on protein surfaces, such as the active site crevice of enzymes, the ligand binding domain of a receptor, and the receptor binding domain of a virus. Nanobodies have great potential as therapeutics and as imaging agents.
We have generated enzyme-blocking nanobodies from llamas immunized with different ARTs: the SpvB Salmonella toxin, the binary clostridium difficile toxin CDTa, and the T cell ecto-enzyme ARTC2 (CD296). These nanobodies protect cells from the cytotoxic effects of SpvB, CDT, and ARTC2. In case of ARTC2, the nanobodies effectively block ARTC2 on the cell surface of regulatory T cells and iNKT cells within 10 minutes after intravenous injection. These nanobodies provide an important tool for protecting these regulatory cells from death induced by NAD released during tissue preparation.
We have also generated nanobodies against CD38, the major NAD-hydrolyzing ecto-enzyme. CD38 is emerging as a therapeutic target in multiple myeloma and other hematopoertic malignancies. Some of our nanobodies outperform the recently licensed CD38-specific monoclonal antibody Daratumumab (Darzalex) in cytotoxicity vs. hematopoetic cancer cell lines.
In cooperation with Ablynx, a Belgian company devoted to developing nanobodies for human therapies, we have generated nanobodies that block or enhance gating of the P2X7 ion channel. The P2X7-blocking nanobodies ameliorated inflammation in mouse models of glomerulonephritis and allergic dermatitis. In endotoxin-treated human blood cells, they effectively blocked LPS/ATP-induced release of the potent pro-inflammatory cytokine IL-1ß.
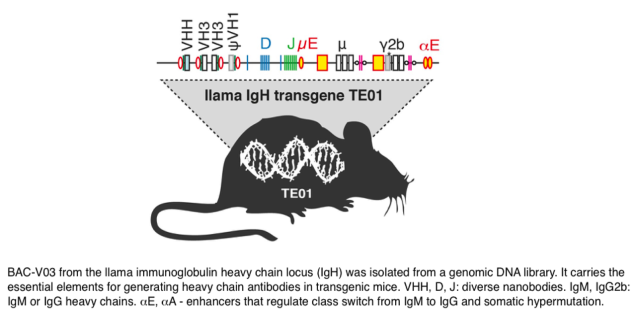
In order to facilitate the generation of new nanobodies, we have cloned the nanobody-encoding IgH locus from llama and successfully transferred an engineered version of this locus to transgenic mice (Fig. 4). Upon immunization, these mice produce nanobody-based heavy chain antibodies that undergo somatic hypermutation and class switch recombination. This novel platform greatly expands our capacity to generate functional nanobodies against interesting targets.3. Posttranslational modifications: ADP-ribosylation, glycosylation, lipid anchors
The function of proteins can be regulated via the attachment of chemical moieties. These enzyme-catalyzed modifications, coined posttranslational modifications (PTMs), include phosphorylation, glycosylation, ADP-ribosylation, and the attachment of lipid anchors.
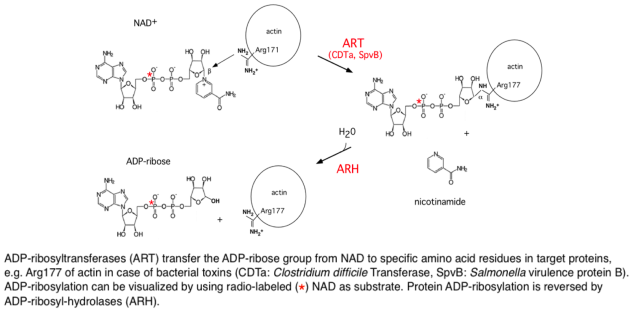
ADP-ribosylation is a reversible PTM, in which ADP-ribosyltransferases (ARTs) transfer the ADP-ribose moiety from NAD onto a specific amino acid side chain in a target protein and ADP-ribosylhydrolases (ARHs) remove the ADP-ribose group (Fig. 5). We have determined the 3D structures of a prototype ART and a prototype ARH. The 3D structure of rat ARTC2 resembles a pacman with a wide-open mouth crunching on the substrate NAD. The 3D structure of human ARH3 resembles a pumpkin in which four alpha helices coordinate two magnesium ions at the bottom of the active site crevice.ADP-ribosylation is used by pathogenic toxins such as Diphtheria, Pertusssis and Clostridial toxins to modulate host protein functions. Toxin-related ARTs are expressed by cells of the immune system. ADP-ribosylation of membrane proteins can be monitored using labeled analogues of NAD. Using 32P-NAD, ADP-ribosylation results in radiolabeling of the target protein. Using etheno-NAD, ADP-ribosylation of target proteins can be detected with a monoclonal antibody directed against etheno-adenosine. This 1G4 antibody can be used to sort cells on the basis of cell surface ART-activity and to purify etheno-ADP-ribosylated proteins.
ARTC2 itself is posttranslationally modified, e.g. by attachment of a GPI lipid anchor (Fig. 1 above). The GPI-anchor targets ARTC2 to lipid rafts, specialized regions of the cell membrane that play an important role in signal transduction, e.g. during activation of T cells by antigen presenting cells. The association of ARTC2 with lipid rafts focuses ARTC2 onto specific target proteins and thereby may regulate the signaling function of raft-associated proteins. ADP-ribosylation of the P2X7 ion channel on arginine residue 125 activates P2X7 to form a non-selective ion-channel, permitting calcium ions to enter the cell and potassium ions to exit the cell. This induces dramatic alterations of the cell membrane, including the externalization of PS, shedding of L-selectin, and formation of membrane blebs.
Ausgewählte Publikationen
reviews
Eggers M, Rühl F, Haag F, Koch-Nolte F. (2021) Nanobodies as probes to investigate purinergic signaling. Biochem Pharmacol. 87:114394. review PMID: 33388283.
Linden J, Koch-Nolte F, Dahl G. (2019) Purine Release, Metabolism, and Signaling in the Inflammatory Response. Annu Rev Immunol. 37:325-347. review. PMID: 30676821
Stortelers C, Pinto-Espinoza C, Van Hoorick D, Koch-Nolte F. (2018) Modulating ion channel function with antibodies and nanobodies. Curr Opin Immunol. 52:18-26. Review PMID: 29579624
Bannas P, Hambach J, Koch-Nolte F. (2017) Nanobodies and Nanobody-Based Human Heavy Chain Antibodies As Antitumor Therapeutics. Front Immunol. 8:1603. Review PMID: 29213270
Wesolowski J, Alzogaray V, Reyelt J, Unger M, Juarez K, Urrutia M, Cauerhff A, Danquah W, Rissiek B, Scheuplein F, Schwarz N, Adriouch S, Boyer O, Seman M, Licea A, Serreze DV, Goldbaum FA, Haag F, Koch-Nolte F. (2009) Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198:157-74. Review PMID: 19529959
Koch-Nolte F, Kernstock S, Mueller-Dieckmann C, Weiss MS, Haag F. (2008) Mammalian ADP-ribosyltransferases and ADP-ribosylhydrolases. Front Biosci. 13:6716-29. PMID: 18508690
research reports
Hambach J, Stähler T, Eden T, Wendt D, Tode N, Haag F, Tolosa E, Altfeld M, Fathi A, Dahlke C, Addo MM, Menzel S, Koch-Nolte F. (2021) A simple, sensitive, and low-cost FACS assay for detecting antibodies against the native SARS-CoV-2 spike protein. Immun Inflamm Dis. 9:905-917. PMID: 33979020.
Schriewer L, Schütze K, Petry K, Hambach J, Fumey W, Koenigsdorf J, Baum N, Menzel S, Rissiek B, Riecken K, Fehse B, Röckendorf JL, Schmid J, Albrecht B, Pinnschmidt H, Ayuk F, Kröger N, Binder M, Schuch G, Hansen T, Haag F, Adam G, Koch-Nolte F, Bannas P. (2020) Nanobody-based CD38-specific heavy chain antibodies induce killing of multiple myeloma and other hematological malignancies. Theranostics. 10:2645-2658. PMID: 32194826
Eichhoff AM, Börner K, Albrecht B, Schäfer W, Baum N, Haag F, Körbelin J, Trepel M, Braren I, Grimm D, Adriouch A, Koch-Nolte F. (2019) Nanobody-enhanced targeting of AAV gene therapy vectors Mol Ther Methods Clin Dev. 15:211-220. PMID: 31687421
Eden T, Menzel S, Wesolowski J, Bergmann P, Nissen M, Dubberke G, Seyfried F, Albrecht B, Haag F, Koch-Nolte F. (2018) A cDNA Immunization Strategy to Generate Nanobodies against Membrane Proteins in Native Conformation. Front Immunol. 8:1989. PMID: 29410663
Danquah W, Meyer-Schwesinger C, Rissiek B, Pinto C, Serracant-Prat A, Amadi M, Iacenda D, Knop JH, Hammel A, Bergmann P, Schwarz N, Assunção J, Rotthier W, Haag F, Tolosa E, Bannas P, Boué-Grabot E, Magnus T, Laeremans T, Stortelers C, Koch-Nolte F. (2016) Nanobodies that block gating of the P2X7 ion channel ameliorate inflammation. Sci Transl Med. 8:366ra162. PMID: 27881823
Adriouch S, Bannas P, Schwarz N, Fliegert R, Guse AH, Seman M, Haag F, Koch-Nolte F. (2008) ADP-ribosylation at R125 gates the P2X7 ion channel by presenting a covalent ligand to its nucleotide binding site. FASEB J. 22:861-9. PMID: 17928361
Koch-Nolte F, Reyelt R, Schössow B, Schwarz N, Scheuplein F, Rothenburg S, Haag F, Alzogaray V, Cauerhff A, Goldbaum F. (2007) Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21:3490-8. PMID: 17575259
Mueller-Dieckmann C, Kernstock S, Lisurek M, von Kries JP, Haag F, Weiss MS, Koch-Nolte F. (2006) The structure of human ADP-ribosylhydrolase 3 (ARH3) provides insights into the reversibility of protein ADP-ribosylation. Proc Natl Acad Sci U S A. 103:15026-31. PMID: 17015823
Otto H, Reche PA, Bazan F, Dittmar K, Haag F, Koch-Nolte F. (2005) In silico characterization of the family of PARP-like poly(ADP-ribosyl)transferases (pARTs). BMC Genomics. 6:139. PMID: 16202152
Bannas P, Adriouch S, Kahl S, Braasch F, Haag F, Koch-Nolte F. (2005) Activity and specifity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on it association with lipid rafts. Blood. 105:3663-70. PMID: 15657180
Seman M, Adriouch S, Scheuplein F, Krebs C, Freese D, Glowacki G, Deterre P, Haag F, Koch-Nolte F. (2003) NAD-induced T cell death: ADP-ribosylation of cell surface proteins by ART2 activates the cytolytic P2X7 purinoceptor. Immunity. 19:571-82. PMID: 14563321
Otto H, Tezcan-Merdol D, Girisch R, Haag F, Rhen M, Koch-Nolte F. (2000) The spvB gene-product of the Salmonella enterica virulence plasmid is a mono(ADP-ribosyl)transferase. Mol Microbiol. 37:1106-15. PMID: 10972829
Koch-Nolte F, Petersen D, Balasubramanian S, Haag F, Kahlke D, Willer T, Kastelein R, Bazan F, Thiele HG. (1996) Mouse T cell membrane proteins Rt6-1 and Rt6-2 are arginine/protein mono(ADPribosyl)transferases and share secondary structure motifs with ADP-ribosylating bacterial toxins. J Biol Chem. 271:7686-93. PMID: 8631807
Koch F, Haag F, Kashan A, Thiele HG. (1990) Primary structure of rat RT6.2, a nonglycosylated phosphatidylinositol-linked surface marker of postthymic T cells. Proc Natl Acad Sci U S A. 87:964-7. PMID: 2300588
Koch F, Thiele HG, Low MG. (1986) Release of the rat T cell alloantigen RT-6.2 from cell membranes by phosphatidylinositol-specific phospholipase C. J Exp Med. 164:1338-43. PMID: 3489808
-
AG Medizinische Immunologie (Prof. Felix Stahl)
Mitarbeiter:innen
Prof. Felix Stahl, Luis Fonseca Brito, Lama Al Jurdi, Emily Kerth, Nan Ma, Dorottya Schöffer, Victoria Tennert
Forschungsprojekte
Virusinfektionen lösen komplexe, gut koordinierte Wirtsreaktionen aus, an denen sowohl die humorale als auch die zelluläre Immunantwort beteiligt sind.Herpesviren sind große, hochgradig angepasste Krankheitserreger, die sich gemeinsam mit ihren Wirten entwickelt haben, um deren Immunabwehr entgegenzuwirken. Das Zytomegalievirus (CMV), ein Mitglied der Familie der Betaherpesvirinae, kodiert eine Reihe von Molekülen, die es ihm ermöglichen, die antivirale Immunabwehr effektiv zu umgehen. CMV führt zu einer chronischen, persistierenden Infektion und wird in der Regel als opportunistischer Erreger betrachtet. Störungen der Immunität des Wirtes können jedoch zu einer verstärkten Virusreplikation und zur Manifestation von CMV-bedingten Krankheiten führen, insbesondere bei immungeschwächten Personen. So ist die kongenitale CMV-Infektion sind die Hauptursache für bleibende Behinderungen bei Neugeborenen, es gibt jedoch bislang noch keinen Impfstoff, und die derzeitigen antiviralen Therapien sind nur bedingt wirksam.
Wir untersuchen die Interaktion zwischen Wirtsimmunzellen und Virusinfektionen in klinisch relevanten Zusammenhängen, wie z. B. einer Infektion im frühen Lebensalter, unter Verwendung modernster Methoden und Modellsysteme. Wir fokussieren dabei auf die antivirale Wirkung von Leukozyten am Ort der Infektion, und wollen die mit der Bekämpfung von Virusinfektionen verbundenen Schwierigkeiten überwinden.
Forschungsnetzwerke
DFG: KFO 296 „Feto-maternal immune cross talk: Consequences for maternal and offspring’s health”
Ausgewählte Publikationen
Fonseca Brito L, Ostermann E, Perez A, Tödter S, Virdi S, Indenbirken D, Glau L, Gieras A, Brixel R, Arens R, Grundhoff A, Arck P, Diemert A, Tolosa E, Brune W, Stahl FR. (2024) Limited protection against early-life cytomegalovirus infection results from deficiency of cytotoxic CD8 T cells. bioRxiv. 2024.07.10.602923.
Fonseca Brito L, Todter S, Kottlau J, Cermann K, Spier A, Petersen E, Schafer I, Twerenbold R, Aepfelbacher M, Lutgehetmann M, Stahl FR. Performance of an interferon-gamma release assay-based test for cell-mediated immunity to SARS-CoV-2. (2023) Front Immunol. 14:1069968.
Fonseca Brito L, Brune W, Stahl FR. Cytomegalovirus (CMV) Pneumonitis: Cell Tropism, Inflammation, and Immunity. (2019) Int J Mol Sci. 20(16).
Stahl FR, Jung R, Jazbutyte V, Ostermann E, Todter S, Brixel R, Kemmer A, Halle S, Rose-John S, Messerle M, Arck PC, Brune W, Renne T. (2018) Laboratory diagnostics of murine blood for detection of mouse cytomegalovirus (MCMV)-induced hepatitis. Sci Rep. 8(1):14823.
Lueder Y, Heller K, Ritter C, Keyser KA, Wagner K, Liu X, Messerle M, Stahl FR#, Halle S#, Forster R#. Control of primary mouse cytomegalovirus infection in lung nodular inflammatory foci by cooperation of interferon-gamma expressing CD4 and CD8 T cells. (2018) PLoS Pathog. 14(8):e1007252.
Halle S, Keyser KA, Stahl FR, Busche A, Marquardt A, Zheng X, Galla M, Heissmeyer V, Heller K, Boelter J, Wagner K, Bischoff Y, Martens R, Braun A, Werth K, Uvarovskii A, Kempf H, Meyer-Hermann M, Arens R, Kremer M, Sutter G, Messerle M, Forster R. (2016) In Vivo Killing Capacity of Cytotoxic T Cells Is Limited and Involves Dynamic Interactions and T Cell Cooperativity. Immunity. 44(2):233-45.
Stahl FR#, Keyser KA#, Heller K, Bischoff Y, Halle S, Wagner K, Messerle M, Forster R. Mck2-dependent infection of alveolar macrophages promotes replication of MCMV in nodular inflammatory foci of the neonatal lung. (2015) Mucosal Immunol. 8(1):57-67.
Stahl FR, Heller K, Halle S, Keyser KA, Busche A, Marquardt A, Wagner K, Boelter J, Bischoff Y, Kremmer E, Arens R, Messerle M, Forster R. (2013) Nodular inflammatory foci are sites of T cell priming and control of murine cytomegalovirus infection in the neonatal lung. PLoS Pathog.9(12):e1003828.
#shared authorships
-
AG Immunregulation (Prof. Eva Tolosa)
Mitarbeiter:innen
Prof. Eva Tolosa, Finja Beer, Julian Dresse, Laura Glau, Romy Hackbusch, Zoe-Isabella Junginger, Manuela Kolster, Jule Krawietz, Jonathan May, Du-Hanh Nguyen, Barsa Priyadarsani Dhal, Nataliia Roschyna, Friederike Thiele, Dr. Kati Tillack, Timon Warschau, Dr. Riekje Winzer
Forschungsprojekte
Adeninnukleotide
Expression, Funktion und Regulation von purinergen Rezeptoren und Adeninnukleotid-metabolisierenden Ektoenzymen
Adeninnukleotide spielen eine Schlüsselrolle in der Modulation der Immunantwort. In unserer Arbeitsgruppe forschen wir an der Freisetzung von Adeninnukleotiden während Entzündungsreaktionen, der Aktivierung von purinergen Rezeptoren und dem Abbau von Adeninnukleotiden durch Ektoenzyme.
Die Konzentration von extrazellulärem Adenosintriphosphat (ATP) ist unter physiologischen Umständen niedrig, steigt aber bei Entzündungsreaktionen oder zellulärem Stress deutlich an. Auch in einigen Geweben wie z.B. dem Darm liegen höhere Konzentrationen an ATP vor. Extrazelluläres ATP dient als Ligand für P2 Rezeptoren, wobei die Stimulation des P2X7-Rezeptors auf Immunzellen zur Freisetzung von pro-inflammatorischen Zytokinen führt. Durch das Zusammenspiel der beiden Ektoenzyme CD39 und CD73 wird ATP in Adenosin (ADO) umgewandelt und somit nicht nur das Gefahrensignal ATP abgebaut, sondern auch anti-inflammatorisches ADO gebildet. Durch diesen Mechanismus wird der Ausgang einer Immunantwort entscheidend beeinflusst.
Bei manchen Erkrankungen wie z.B. Tumorerkrankungen ist es therapeutisch von Vorteil die Immunantwort zu verstärken, andere Krankheitsbilder wie z.B. bei Autoimmunerkrankungen hingegen erfordern eine immunsuppressive Therapie. Die Modulierung der ATP-ADO-Achse durch Regulation von Ektoenzymen und purinergen Rezeptoren, stellt somit ein interessantes Forschungsziel für den ersten Schritt zur Entwicklung immunmodulatorischer Therapien dar. Durch den Einsatz von Inhibitoren und Knock-Out-Systemen wollen wir den zellspezifischen Einfluss dieser Ektoenzyme und Rezeptoren modulieren und so mögliche Angriffspunkte für die Regulation von Immunantworten charakterisieren.
Laufende Projekte in unserer Arbeitsgruppe bezogen auf Adeninnukleotide sind:
Analyse der Rolle der ATP- und Adenosinrezeptor-Signalgebung für die Immunadaptation von intestinalen Th17-Zellen. PI: Prof. Eva Tolosa, Prof. Nicola Gagliani; Teilprojekt A14.
In entzündetem Gewebe vermitteln Th1- und Th17-Zellen gewebsschädigende Prozesse durch die Sekretion von pro-inflammatorischen Zytokinen. Einige dieser Effektor-Zellen besitzen ein gewisses Maß an Plastizität und können einen anti-inflammatorischen Phänotyp annehmen (dieser Prozess wird auch als Immunadaption bezeichnet), wodurch sie zur Bewältigung der Entzündung beitragen. Unsere Hypothese ist, dass die Hydrolyse von extrazellulärem ATP zu ADO durch Th1- und Th17-Zellen sowie ADO-Rezeptor-vermittelte Signalwege zur Umwandlung dieser Zellen in regulatorische Zellen beitragen. Um die Rolle der Ektonukleotidasen CD39 und CD73 für die Bildung von ADO und die Rolle von ADO-Rezeptor-vermittelten Signalwegen für die Immunadaption zu untersuchen, werden wir in vitro Experimente mit humanen Th1- und Th17-Zellen durchführen und, in Kooperation mit Prof. Nicola Gagliani, Zytokin-Reporter Mausmodelle im Kontext der intestinalen Entzündung verwenden.
Verknüpfung funktioneller Immunprofile und ischämischer Läsionseigenschaften beim Schlaganfall im Menschen PI: Prof. Eva Tolosa (Immunologie, UKE Hamburg), Prof. Götz Thomalla (Neurologie, UKE Hamburg) and Prof. Luisa Klotz and Heinz Wiendl (Neurologie, Uni. Münster), FOR 2879 Teilprojekt C1
Ein ischämischer Schlaganfall induziert eine schnelle immunologische Reaktion, bei der Leukozyten aus der Peripherie in die ischämisch geschädigte Region einwandern. Gleichzeitig lässt sich bei Schlaganfallpatienten eine klinisch relevante Immunsuppression feststellen. Ziel dieses Projekts ist es, die Dynamik der schlaganfallbedingten Veränderungen in Bezug auf die Immunsignatur und die funktionellen Eigenschaften der Immunzellen im peripheren Blut zu erforschen, wobei der Schwerpunkt auf der purinergen Signalübertragung als möglichem Mechanismus der schlaganfallbedingten Immunsuppression liegt. Die immunologischen Veränderungen werden mit dem Subtyp des Schlaganfalls, den Charakteristika der ischämischen Schlaganfallläsionen und dem Krankheitsverlauf korreliert mit dem Ziel, Risikopatienten frühzeitig zu identifizieren und eine spezifische Behandlung zu ermöglichen.
Thymus Funktionen in Gesundheit und Krankheit
Der Thymus ist ein primäres lymphatisches Organ und spielt eine entscheidende Rolle in der T-Zell-Entwicklung. Streng kontrollierte Selektionsprozesse ermöglichen die Etablierung einer funktionellen und selbst-toleranten Immunantwort gegen Pathogene und Tumore, ohne dabei zur Autoimmunität zu führen. Bei der Geburt ist die Thymusfunktion auf Ihrem Höhepunkt. In dieser Zeit können Effekte auf den Thymus ernsthafte Konsequenzen für die Immunität des Kindes haben. In unserem Labor untersuchen wir eine Reihe von frühkindlichen Faktoren, welche zu einem Rückgang oder sogar Verlust der Thymusfunktion führen. Die Gründe hierfür können vielfältig sein und reichen von medizinischen Interventionen (z.B. pränatale Steroidgabe, frühkindliche Thymektomie) bis hin zu angeborenen Erkrankungen (z.B. Down Syndrom). Die Konsequenzen könnten weit über die ersten Lebensmonate hinaus reichen, und zu einer beeinträchtigten Immunität führen (z.B. Entwicklung von chronischen Erkrankungen oder Autoimmunerkrankungen).
Aktuelle Projekte des Labors zu diesen Arbeiten:
Auswirkungen der frühkindlichen Thymektomie auf das Immunsystemn PI: Dr. Anna Gieras, unterstützt von der Deutschen Herzstiftung
Frühkindliche medizinische Interventionen können sich nachteilig auf die Thymusentwicklung auswirken und müssen daher sorgfältig überprüft werden, um mögliche unerwünschte Nebenwirkungen zu verhindern. Wir untersuchen den Einfluss der frühkindlichen Thymektomie auf die Thymusfunktion sowie die Entwicklung des adaptiven Immunsystems.
Kooperation mit Jörg Sigmar Sachweh, Daniel Biermann
Mechanistische Einblicke in Thymusfunktion und Immundefekte bei Down Syndrom PI: Dr. Anna Gieras, unterstützt von der Werner-Otto-Stiftung
Wir untersuchen den Einfluss angeborener Erkrankungen auf eine verminderte Thymusfunktion mit besonderen Fokus auf Down Syndrom Patienten. Diese Patienten haben ein verändertes peripheres Immunsystem, jedoch sind die zugrundeliegenden Mechanismen welche zu einem veränderten T-Zell-Pool führen weitgehend unbekannt. Auch detaillierte Analysen der Thymusdrüse fehlen bisher. Unsere vorläufigen Daten zeigen eine gestörte Entwicklung unreifer Thymozyten (ex vivo und in vivo). Aktuell erforschen wir die zugrundeliegenden molekularen Mechanismen.
In vitro Studien der Thymusfunktionen im Menschen stellen eine Herausforderung dar, insbesondere aufgrund der limitierten Verfügbarkeit von Thymusgewebe. Um die Thymusumgebung in vitro nachzustellen, haben wir humane 3D-Thymusorganoide hergestellt. Mit diesen kann die Entwicklung der T-Lymphozyten aus vom Patienten stammenden Vorläuferzellen untersucht und beeinflusst werden.
Immunphänotypisierung
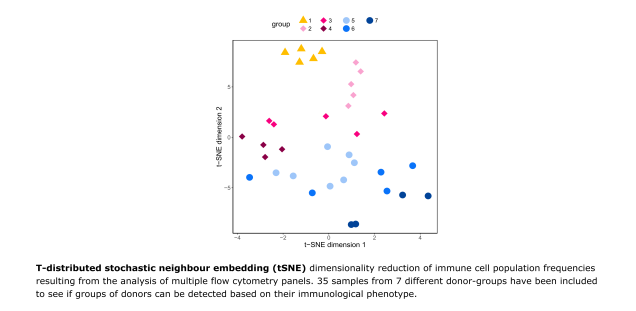
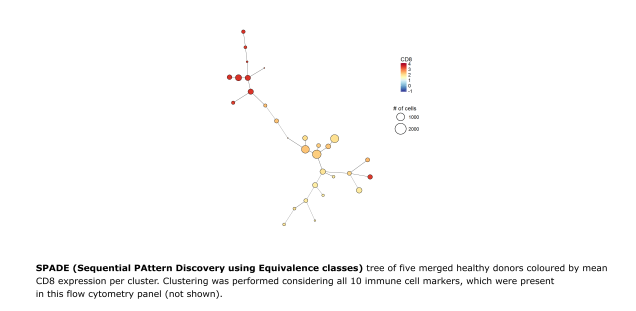
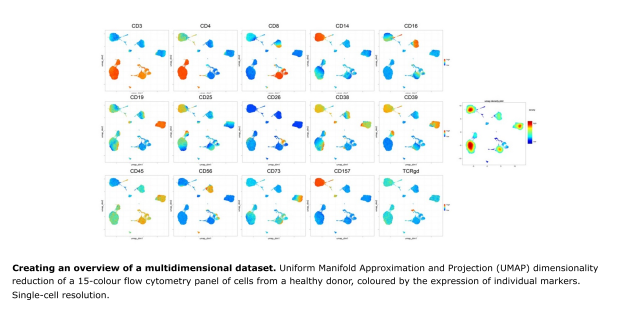
Hochauflösende Multiparameter-Durchflusszytometrie zur Erstellung von Profilen des Immunsystems im gesunden wie im erkrankten Zustand
Die Erstellung von Profilen des Immunsystems einer Person dient dazu, eine Momentaufnahme des Immunsystems zu erhalten. Diese ermöglicht die Identifizierung von Immunmerkmalen, die mit einer Krankheit, einem genetischen Defekt, dem Alter usw. zusammenhängen. Während Immunzellen in erkrankten im Vergleich zu Immunzellen in gesunden Organen erhebliche Unterschiede aufweisen können, sind die Veränderungen im peripheren Blut oft nicht so ausgeprägt. Daher ist eine tiefgreifende Phänotypisierung des Immunsystems einschließlich einer Funktionsbewertung und einer projektspezifischen bioinformatischen Analyse erforderlich, um krankheits- oder gruppenassoziierte Merkmale zu erkennen ( Immunostroke FOR 2879, C1 ). In unserem Labor haben wir spezifische Panel entwickelt, um den Immunstatus in Abhängigkeit vom Alter zu untersuchen und spezifischen Panel für Nabelschnurblut ( KFO296 Projekt S1 ), für Immunantworten nach Impfungen, für den Vergleich von peripherem Blut mit organ- und tumorinfiltrierenden Zellen, sowie unter anderem für die Bewertung von krankheitsbezogenen Immuneigenschaften etabliert. Darüber hinaus nutzen wir eine Abfolge bioinformatischer Methoden für die schnelle Bewertung von Veränderungen im Immunstatus von Individuen und für die unvoreingenommene/neutrale Analyse von Rohdaten zur Quantifizierung von Clustern mit unterschiedlicher Häufigkeit in vordefinierten Patientengruppen oder Zellkompartimenten.
Forschungsnetzwerke
DFG: SFB 1328 Adenine nucleotides in immunity and inflammation
DFG: FOR 2879 ImmunoStroke
Ausgewählte Publikationen
Bremer SJ#, Boxnick A#, Glau L, Biermann D, Joosse S, Thiele F, Billeb E, May J, Kolster M, Hackbusch R, Fortmann M, Kozlik-Feldmann R, Hübler M, Tolosa E, Sachweh J, Gieras A (2024) Thymic Atrophy and Immune Dysregulation in Infants with Complex Congenital Heart Disease. J Clin Immunology;44:69
Winzer R, Serracant-Prat A, Brock V, Pinto-Espinoza C, Rissiek B, Amadi M, Eich N, Rissiek A, Schneider E, Magnus T, Guse A, Diercks B, Koch-Nolte F, Tolosa E (2022) P2X7 is expressed on human innate-like T lymphocytes and mediates susceptibility to ATP-induced cell death. Eur J Immunol;52(11):1805-1818
Schneider E#, Winzer R#, Rissiek A, .., Magnus T, Fliegert R, Müller CE, Gagliani N, Tolosa E (2021) CD73-mediated adenosine production by CD8 T cell-derived extracellular vesicles constitutes an intrinsic mechanism of immune suppression in humans. Nat Commun;12:5911
Poch T, Krause J, Casar C, Liwinski T, Glau L, …Huber S, Tolosa E#, Gagliani N#, Schramm C# (2021) Single-cell atlas of hepatic T cells reveals expansion of liver-resident naive-like CD4+ T cells in primary sclerosing cholangitis. J Hepatol; S0168-8278(21)00219-1
Bremer SJ, Glau L, Gehbauer C, Boxnick A, Biermann D, Sachweh JS, Tolosa E, Gieras A. (2021) OMIP 073: Analysis of human thymocyte development with a 14-color flow cytometry panel. Cytometry A. 99(9):875-879.
Lessel D#, Gehbauer C#, Bramswig NC, Schluth-Bolard C, Venkataramanappa S, van Gassen KLI,… Agrawal PB, Britsch S, Tolosa E#, Kubisch C# (2018) BCL11B mutations in patients affected by a neurodevelopmental disorder with reduced type 2 innate lymphoid cells. Brain; 141(8):2299-311
Mohme M, Schliffke S, Maire CL, Runger A, Glau L, … Westphal M, Binder M#, Tolosa E#, Lamszus K# (2018) Immunophenotyping of Newly Diagnosed and Recurrent Glioblastoma Defines Distinct Immune Exhaustion Profiles in Peripheral and Tumor-infiltrating Lymphocytes. Clin Cancer Res; 24(17):4187-200
Gieras A, Gehbauer C, Perna-Barrull D, Engler JB, Diepenbruck I, Glau L, Joosse SA, Kersten N, Klinge S, Mittrücker HW, Friese MA, Vives-Pi M, Tolosa E. (2017) Prenatal administration of betamethasone causes changes in the T cell receptor repertoire influencing development of autoimmunity. Frontiers in Immunology. 8:1505
Thom V, Schmid S, Gelderblom M, Hackbusch R, Kolster M, .., Pless O, Bernreuther C, Glatzel M, Wegscheider K, Gerloff C, Magnus T#, Tolosa E# (2016) IL-17 production by CSF lymphocytes as a biomarker for cerebral vasculitis. Neurol Neuroimmunol Neuroinflamm; 3(2):e214
Rissiek A, Baumann I, Cuapio A, Mautner A, Kolster M, Arck PC, Dodge-Khatami A, Mittrucker HW, Koch-Nolte F, Haag F, Tolosa E (2015) The expression of CD39 on regulatory T cells is genetically driven and further upregulated at sites of inflammation. J Autoimmun; 58:12-20.
Adamopoulou E, Tenzer S, Hillen N, Klug P, Rota IA, Tietz S, Gebhardt M, Stevanovic S, Schild H, Tolosa E, Melms A, Stoeckle C (2013) Exploring the MHC-peptide matrix of central tolerance in the human thymus. Nat Commun. 4:2039
Stoeckle C, Quecke P, Ruckrich T, Burster T, Reich M, Weber E, Kalbacher H, Driessen C, Melms A, Tolosa E (2012) Cathepsin S dominates autoantigen processing in human thymic dendritic cells. J Autoimmun. 38 (4):332-343
Brucklacher-Waldert V, Stuerner K, Kolster M, Wolthausen J, Tolosa E (2009) Phenotypical and functional characterization of T helper 17 cells in multiple sclerosis. Brain. 132:3329-3341
Feger U*, Tolosa E#, Huang Y-H, Waschbisch A, Biedermann T, Melms A, Wiendl H (2007) HLA-G expression defines a novel regulatory T-cell subset present in human peripheral blood and sites of inflammation. Blood. 110 (2):568-577
Tolosa E, Li W, Yasuda Y, Wienhold W, Denzin LK, Lautwein A, Driessen C, Schnorrer P, Weber E, Stevanovic S, Kurek R, Melms A, Bromme D (2003) Cathepsin V is involved in the degradation of invariant chain in human thymus and is overexpressed in myasthenia gravis. Journal of Clinical Investigation. 112 (4):517-526
Tolosa E, King LB, Ashwell JD (1998) Thymocyte Glucocorticoid Resistance Alters Positive Selection and Inhibits Autoimmunity and Lymphoproliferative Disease in MRL-lpr/lprMice. Immunity. 8 (1):67-76
#shared authorships
-
NG Vektorbasierte Immuntherapie (Dr. Anna Marei Mann)
Group members
Dr. Anna Marei Mann (née Eichhoff), Dr. Waldemar Schäfer, Nathalie Richter, Saruul Jargalsaikhan, Laura J. Becerra Moreno
Research interests
Adeno-associated viruses (AAV) are promising vectors for gene therapy due to their ability to infect a broad range of cells and tissues with minimal immunogenicity and toxicity but long-term expression of the transferred gene. A major challenge for therapeutic applications of AAV vectors is the low cell specificity of naturally occurring AAV serotypes and the high transduction of cells in the liver. Thus, high vector doses are often required to reach the tissue of interest, resulting in side effects and high production costs. We developed two novel technologies to enhance AAV-mediated transduction of target cells that express a specific membrane protein. One technology uses the genetic insertion of a membrane protein-specific nanobody (Nb) into the viral capsid (Fig. 1A), the other uses nanobody-based adaptor proteins (Fig. 1B). Nanobodies are the single variable immunoglobulin domains of heavy-chain antibodies from Camelids, i.e. alpacas and llamas. In contrast to conventional IgG antibodies, heavy chain antibodies do not associate with a light chain and their heavy chain lacks the CH1 domain (Fig. 1C). Nanobodies are used as targeting tools in research, diagnostics, imaging and therapy. The small size, high solubility and excellent stability account for the ease of reformatting.
Figure 1: The lab 'Vectored Immunotherapy' focuses on two strategies to retarget AAV vectors using membrane protein-specific nanobodies (Nbs). (A) Firstly, we retarget an AAV to a specific cell and/or tissue type by genetically inserting a membrane protein-specific nanobody into the viral capsid. The scheme depicts an AAV (grey/green) displaying a nanobody (Nb, cyan) on the capsid surface with a packaged DNA transgene (white) encoding a therapeutic gene product. The structural model of AAV9 (PDB ID: 3UX1) with a Nb inserted into a surface loop of VP1 was generated with AlphaFold and PyMol. (B) In a second strategy we retarget AAV to specific cells expressing the cognate membrane protein using a bispecific nanobody-based adaptor protein. One nanobody of the adaptor binds the AAV, the other nanobody binds a specific membrane protein. (C) Conventional antibodies (yellow) produced by all mammals are composed of two heavy and two light chains. The tip of two variable domains (red) (VH, VL) mediates specific binding to a target. In contrast, camelid heavy chain antibodies (cyan) consist only of heavy chains. Specific target binding is mediated by a single variable domain designated nanobody. Nanobodies are small (15 kDa), robust and highly soluble.
Current projects in the lab:
'nAAVi2mub - Nanobody-mediated AAV delivery to muscle and brain cells', research project funded by the Werner Otto Stiftung, PI: Dr. Anna Marei Mann.
Duchenne muscular dystrophy (DMD) is a fatal disease that manifests early during infancy or childhood and affects skeletal muscle, heart and diaphragm. This monogenic hereditary disorder is caused by a loss-of-function mutation. The recent approval of the AAV-based gene therapy 'Elevidys' for the treatment of DMD highlights the utility of AAV capsids with improved therapeutic efficacy and specificity. In this project, we insert nanobodies specific for an ecto-enzyme exclusively expressed on skeletal and heart muscle cells into receptor-blinded AAV2 and AAV9 variants. We evaluate the targeting specificity of such Nanobody-displaying AAV constructs in vitro on mouse and human muscle cell lines and in vivo in different mouse models.
'Nanobody-displaying AAV9 for the treatment of glioblastoma', part of the joint project THUNDER ('National Hub for Nanobody Cancer Theranostics') of the UKE and the UK Bonn funded by the German Cancer Aid (Deutsche Krebshilfe). Project-specific UKE partners: Prof. Friedrich Nolte (Inst. of Immunology); Prof. Peter Bannas, Dr. Julia Hambach (Radiology); Dr. Cecile Maire, Dr. Malte Mohme and Prof. Katrin Lamszus (Neurosurgery).
Glioblastoma is a devastating tumor characterized by a cold tumor microenvironment with inactive immune cells. In this project, we aim to use AAV vectors to express immune-activating cytokines (e.g. IL-12) and checkpoint- or purinergic signaling-inhibiting nanobodies (e.g. PD-L1 or CD73 and CD39) in order to promote an immune-activating tumor microenvironment. To efficiently transduce the tumor cells with AAV, we insert nanobodies specific for membrane proteins overexpressed by glioblastoma cells into the viral capsid of AAV9 and variants thereof.
'Nanobody-based adaptor proteins to retarget AAV vectors to specific cells' PI: Dr. Anna Marei Mann.
Our lab developed a technology to enhance AAV-mediated transduction of specific target cells using nanobody-based adaptor proteins. Such adaptors consist of two genetically fused nanobodies: an AAV-specific nanobody and a membrane protein-specific nanobody (Fig. 1B). We successfully selected nanobodies against various AAV serotypes including AAV1, 2, 4, 8 and 9 from immunized llama IgH-transgenic LamaMice (Eden et al. 2024, Nat. commun.). With these nanobodies we generated a variety of adaptors recognizing specific membrane proteins, including CD38, CD73, CD203a, CD296 and P2X7. We verified the capacity of these adaptors to enhance AAV-mediated transduction of cells expressing the cognate membrane protein. We aim to provide these adaptor proteins for academic and commercial partners as tools to improve the transduction of different cell types with various AAV serotypes.
'TransCAR: Transient CAR expression by targeted transfection of T lymphocytes with nanobody-targeted lipid nanoparticles (LNPs)', part of the transCAR consortium funded by the Landesforschungsförderung Hamburg, PIs: Dr. Julia Hambach, Dr. Anna Marei Mann.
A major goal of the transCAR consortium is to enable T cells and NK cells to express tumor-cell specific chimeric antigen receptors (CARs) using nanobody-targeted lipid nanoparticles (LNPs) that encapsulate a CAR-encoding mRNA. The goal of the project led by Dr. Julia Hambach and Dr. Anna Marei Mann is to generate nanobodies specific for membrane proteins expressed on T cells or NK cells, e.g. CD8 or CD16. Lipid nanoparticles will be conjugated with such nanobodies in order to specifically transfect T and NK cells.
Research networks
THUNDER ('National Hub for Nanobody Cancer Theranostics'), University Medical Center Hamburg-Eppendorf (UKE) and University Medical Center Bonn (UKB), funded by the German Cancer Aid.
Transiente CAR-Effektorzellen: Neue Ansätze zu ihrer Herstellung und effizienten Anwendung (TransCAR), UKE and UHH, funded by Landesforschungsförderung Hamburg.
Selected publications
Eden T, Schaffrath AZ, Wesolowski J, Stahler T, Tode N, Richter N, Schafer W, Hambach J, Hermans-Borgmeyer I, Woens J, Le Gall CM, Wendler S, Linke-Winnebeck C, Stobbe M, Budnicki I, Wanney A, Heitz Y, Schimmelpfennig L, Schweitzer L, Zimmer D, Stahl E, Seyfried F, Gebhardt AJ, Dieckow L, Riecken K, Fehse B, Bannas P, Magnus T, Verdoes M, Figdor CG, Hartlepp KF, Schleer H, Funer J, Tomas NM, Haag F, Rissiek B, Mann AM, Menzel S & Koch-Nolte F (2024). Generation of nanobodies from transgenic 'LamaMice' lacking an endogenous immunoglobulin repertoire. Nat Commun, 15: 4728.
Abad C, Demeules M, Guillou C, Gonde H, Zoubairi R, Tan YV, Pinto-Espinoza C, Schafer W, Mann AM, Vouret-Craviari V, Koch-Nolte F & Adriouch S (2024). Administration of an AAV vector coding for a P2X7-blocking nanobody-based biologic ameliorates colitis in mice. J Nanobiotechnology, 22: 27.
Hambach J, Mann AM, Bannas P & Koch-Nolte F (2022). Targeting multiple myeloma with nanobody-based heavy chain antibodies, bispecific killer cell engagers, chimeric antigen receptors, and nanobody-displaying AAV vectors. Front Immunol, 13: 1005800.
Mann AM, Schafer W, Adriouch S, Borner K, Grimm D, Braren I & Koch-Nolte F (2022). Enhanced Transduction of P2X7-Expressing Cells with Recombinant rAAV Vectors. Methods Mol Biol, 2510: 129-144.
Demeules M, Scarpitta A, Abad C, Gonde H, Hardet R, Pinto-Espinoza C, Eichhoff AM, Schafer W, Haag F, Koch-Nolte F & Adriouch S (2020). Evaluation of P2X7 Receptor Function in Tumor Contexts Using rAAV Vector and Nanobodies (AAVnano). Front Oncol, 10: 1699.
Eichhoff AM, Borner K, Albrecht B, Schafer W, Baum N, Haag F, Korbelin J, Trepel M, Braren I, Grimm D, Adriouch S & Koch-Nolte F (2019). Nanobody-Enhanced Targeting of AAV Gene Therapy Vectors. Mol Ther Methods Clin Dev, 15: 211-220.
Koch-Nolte F, Eichhoff A, Pinto-Espinoza C, Schwarz N, Schafer T, Menzel S, Haag F, Demeules M, Gonde H & Adriouch S (2019). Novel biologics targeting the P2X7 ion channel. Curr Opin Pharmacol, 47: 110-118.
Seifert L, Hoxha E, Eichhoff AM, Zahner G, Dehde S, Reinhard L, Koch-Nolte F, Stahl RaK & Tomas NM (2018). The Most N-Terminal Region of THSD7A Is the Predominant Target for Autoimmunity in THSD7A-Associated Membranous Nephropathy. J Am Soc Nephrol, 29: 1536-1548.