Experimentelle Unfallchirurgie
Leitung:
Univ.-Prof. Dr. med. Dr. rer. biol. hum. Johannes Keller
Mail:
j.keller@uke.de
Sekretariat Forschung:
Cécile Bredow
Mail:
c.bredow@uke.de
Telefon:
Fax: +49 (0) 40 7410 - 40085
-
Überblick
Die Experimentelle Unfallchirurgie am UKE untersucht durch translationale Forschungsansätze klinisch relevante Fragestellungen im Bereich der Unfallchirurgie und der muskuloskelettalen Medizin. Durch die radiologische, histologische und molekulare Untersuchung von klinischen Proben sowie die Verwendung modernster experimenteller Verfahren bearbeiten wir traumatologische Forschungsprojekte mit dem übergeordneten Ziel, neue und innovative Therapieansätze für betroffene Patienten zu entwickeln.
Einer unserer Schwerpunkte stellt die Identifikation und das funktionelle Verständnis von lokalen und systemischen Mediatoren dar, die essenziell für die Knochenregeneration sind und die pharmakologisch zur Behandlung der gestörten Knochenheilung (Pseudarthrose) genutzt werden können. Gleichermaßen untersuchen wir zelluläre und molekulare Signalmechanismen, die die Funktion von Knochenzellen regulieren und sich somit zur Behandlung von Skeletterkrankungen wie beispielsweise der Osteoporose oder ektopischer Knochenformation eignen. In Kooperation mit weiteren Universitätskliniken untersuchen wir zudem die posttraumatische Entzündungsreaktion und die Sepsis, die bei schwerverletzten Patienten aufgrund von nachfolgendem Organversagen zu komplikationsreichen Verläufen führen können. Biomarker bei post-traumatischer Gelenkdegeneration, Implantat-assoziierte Infektionen, heterotope Ossifikationen und die Anwendung des 3D-Drucks in der Unfallchirurgie stellen weitere wissenschaftliche Inhalte dar, die von unserem Team zur Verbesserung aktuell verfügbarer Therapieoptionen bearbeitet werden.
Neben einer Vielzahl nationaler und internationaler Kollaborationen arbeiten wir am UKE eng mit der Klinik für Orthopädie und dem Institut für Osteologie und Biomechanik (IOBM) zusammen. Hierdurch wird eine gezielte Fokussierung der verschiedenen Kernkompetenzen erreicht, sodass muskuloskelettale Forschung auf höchstem Niveau ermöglicht wird.
Wir freuen uns, wenn Sie sich auf den folgenden Seiten ein Bild über unser Team und unsere translationalen Forschungsaktivitäten und unser Team machen.
-
Team
Leitung
 Univ.-Prof. Dr. Dr. med.Johannes Keller
Univ.-Prof. Dr. Dr. med.Johannes Keller- Leiter der Sektion
TelefonE-MailStellvertretende Leitung:
 Dr. rer. nat.Anke Baranowsky
Dr. rer. nat.Anke Baranowsky- Zentrum für Operative Medizin
- Klinik und Poliklinik für Unfallchirurgie und Orthopädie - Fachbereich Unfallchirurgie
Standort
Campus Forschung I - N27 , 1. EtageMildred-Scheel Nachwuchswissenschaftlerin:
 Standort
Standort
Campus Forschung I - N27 , 1. EtageClinician Scientist:
 Dr. med.Tobias Malte Ballhause
Dr. med.Tobias Malte Ballhause- Zentrum für Operative Medizin
- Klinik und Poliklinik für Unfallchirurgie und Orthopädie - Fachbereich Unfallchirurgie
Standort
Campus Forschung I - N27 , 1. EtagePostdoc:
 Standort
Standort
Campus Forschung I - N27 , 1. EtageWissenschaftlicher Mitarbeiter:
 Standort
Standort
Campus Forschung I - N27 , 1. EtagePhD-Studenten:
 Chiara GerrietsM. Sc.
Chiara GerrietsM. Sc.- PhD Student
Standort
Campus Forschung I - N27 , 1. Etage Dr. med.Paul Knapstein
Dr. med.Paul Knapstein- Wissenschaftlicher Mitarbeiter
- Zentrum für Operative Medizin
- Klinik und Poliklinik für Unfallchirurgie und Orthopädie - Fachbereich Unfallchirurgie
- Assistenzarzt in Weiterbildung
Standort
Hauptgebäude O10 , 2. Etage Standort
Standort
Campus Forschung I - N27 , 1. Etage Dr. med.Weixin Xie
Dr. med.Weixin Xie- PhD Student
Standort
Campus Forschung I - N27 , 1. EtageMD-Studenten (mind. 1 Jahr Vollzeit im Lab):
 Lilly-Charlotte Albertsen
Lilly-Charlotte Albertsen- Medizin-Doktorandin
- Zentrum für Operative Medizin
- Klinik und Poliklinik für Unfallchirurgie und Orthopädie - Fachbereich Unfallchirurgie
Standort
Campus Forschung I - N27 , 1. Etage Antonia Donat
Antonia Donat- Medizin-Doktorandin
- Zentrum für Operative Medizin
- Klinik und Poliklinik für Unfallchirurgie und Orthopädie - Fachbereich Unfallchirurgie
Standort
Campus Forschung I - N27 , 1. Etage Christine Dowling
Christine Dowling- Medizin-Doktorandin
- Zentrum für Operative Medizin
- Klinik und Poliklinik für Unfallchirurgie und Orthopädie - Fachbereich Unfallchirurgie
Standort
Campus Forschung I - N27 , 1. Etage Judith Luisa Kokot
Judith Luisa Kokot- Medizin-Doktorandin
Standort
Campus Forschung I - N27 , 1. Etage Nico Rademann
Nico Rademann- Medizin-Doktorand
Standort
Campus Forschung I - N27 , 1. Etage Florian Rapp
Florian Rapp- Medizin-Doktorand
Standort
Campus Forschung I - N27 , 1. Etage Jan Sevecke
Jan Sevecke- Medizin-Doktorand
Standort
Campus Forschung I - N27 , 1. Etage Til Schoberwalter
Til Schoberwalter- Medizin-Doktorand
Standort
Campus Forschung I - N27 , 1. EtageTechnische Assistentinnen:
 Cordula Erdmann
Cordula Erdmann- Technische Angestellte
- Zentrum für Operative Medizin
- Klinik und Poliklinik für Unfallchirurgie und Orthopädie - Fachbereich Unfallchirurgie
Standort
Campus Forschung I - N27 , 1. Etage Mayla Rickert
Mayla Rickert- Technische Angestellte
- Zentrum für Operative Medizin
- Klinik und Poliklinik für Unfallchirurgie und Orthopädie - Fachbereich Unfallchirurgie
Standort
Campus Forschung I - N27 , 1. EtageSekretariat Forschung:
Standort
Hauptgebäude O10 , 2. Etage -
Experimentell-Translationale Forschungsschwerpunkte
Zelluläre und molekulare Charakterisierung der Frakturheilung
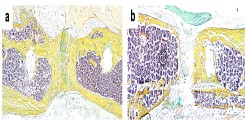
Trotz mittlerweile hochqualitativer und sicherer Versorgung von Frakturen heilt der Knochen in 10-15% der Fälle nicht und es entsteht eine sogenannte Pseudarthrose. Dieses Krankheitsbild ist neben hohen Behandlungskosten mit starken Schmerzen, multiplen Revisionseingriffen, Immobilität, und Arbeitsausfällen assoziiert, sodass die Patienten und ihre Familien einem hohen Leidensdruck ausgesetzt sind. Durch unsere Forschung möchten wir die Pathophysiologie von Pseudarthrosen besser verstehen, um somit neue diagnostische und therapeutische Konzepte für betroffene Patienten entwickeln zu können.
Abb: Histologische Darstellung (Movat-Pentachromfärbung) einer heilenden (a) und nicht-heilenden (b) Fraktur am Röhrenknochen. Mineralisierter Knochen erscheint gelb.
Zelluläre und molekulare Grundlagen der Osteoporose
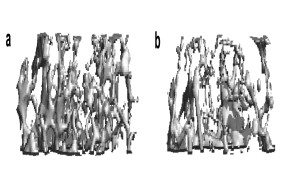
Knochenschwund (Osteoporose) ist die häufigste Knochenerkrankung des Menschen. Obwohl die Erkrankung lange asymptomatisch verläuft, kommt es im fortgeschrittenen Stadium zu einer verminderten Knochenmasse und -qualität sowie zu einem stark erhöhten Frakturrisiko. Auslöser dieser Erkrankung ist ein Ungleichgewicht der Aktivität von Knochenzellen, den knochenbildenden Osteoblasten und den knochenresorbierenden Osteoklasten. In unserer Forschung untersuchen wir die Regulation dieser Zellen mit dem Ziel, neuartige Faktoren zu identifizieren, die dem Knochenabbau entgegenwirken und die Bildung von neuem Knochen fördern.
Abb.: Radiologische Darstellung (µCT) der veränderten Knochenstruktur bei Knochenmasseverlust. (a) Normale trabekuläre Knochenarchitektur. (b) Rarifizierte und verdünnte Trabekelstruktur bei post-menopausaler Osteoporose
Molekularbiologische Analyse der post-traumatischen Arthrose
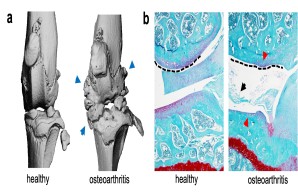
Eine Gelenkverletzung ist ein häufiger Grund für das Entstehen eines post-traumatischen Gelenkverschleißes (Arthrose). Neben symptomatischen Behandlungen steht aktuell einzig der künstliche Gelenkersatz zur Therapie der fortgeschrittenen Arthrose zu Verfügung. In unserer Arbeitsgruppe untersuchen wir daher die Pathophysiologie der post-traumatischen Arthrose mit modernsten experimentellen Verfahren, um langfristig neue Behandlungsstrategien für betroffene Patienten entwickeln zu können.
Abb.: Radiologische (µCT; a) und histologische (b) Darstellung der Gelenkveränderungen bei post-traumatischer Arthrose. Es kommt zum Auftreten der klassischen Arthrose-Zeichen mit Osteophyten (blaue Pfeile), Meniskusdegeneration (schwarzer Pfeil), Gelenkdeformation (gestrichelte Linie) und Verlust des Gelenkknorpels (rote Pfeile).
Zelluläre Kommunikationsmechanismen in der Osteoimmunologie
Das Zusammenspiel von Knochen- und Immunzellen spielt bei vielen Erkrankungen eine große Rolle. Diese Interaktion ist nicht nur beim normalen oder pathologischen Knochenumbau wichtig (z.B. Osteoporose), sondern steuert auch degenerative (z.B. Arthrose) und regenerative Prozesse (z.B. Frakturheilung). In unserer Arbeit charakterisieren wir daher den Einfluss bestimmter Immunzellen auf den Knochenumbau, die Gelenkdegeneration und die Knochenheilung, und untersuchen, inwiefern sich immunmodulatorische Substanzen zur Behandlung von Skeletterkrankungen eignen.
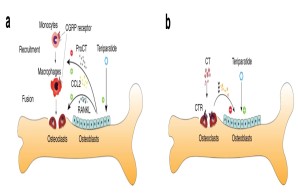
Abb.: Interaktion von Knochen- mit Immunzellen nach osteoanaboler Teriparatid-Therapie. (a) Teriparatid induziert die Expression von Procalcitonin (ProCT) in Osteoblasten, was die Rekrutierung von Osteoklastenvorläufern (d. h. Monozyten und Makrophagen) an der Knochenoberfläche beeinträchtigt und somit die Knochenresorption hemmt. (b) Zirkulierendes Calcitonin (CT) beeinträchtigt die osteoanabole Wirkung von iPTH auf der Grundlage einer tonischen Hemmung der Knochenbildung, vermutlich über Osteoklasten. Modifiziert nach Baranowsky et al., Bone Research 2022.
Inflammation und Regeneration nach spinalem Trauma
Das spinale Trauma stellt auch heutzutage ein schwerwiegendes Krankheitsbild mit ernsten Folgen für betroffene Patienten dar. Während der sekundären Phase nach Rückenmarkverletzung kommt es insbesondere durch die Inflammationsreaktion zu progredientem Zelluntergang und konsekutiv verschlechterter motorischer Funktion. Mithilfe modernster experimenteller Verfahren untersuchen wir, welche Effekte spezifische immunmodulatorische Substanzen auf die Sekundärphase und damit die spinale Regeneration und das klinische Outcome haben.
Regulation der post-traumatischen Entzündungsreaktion und der Sepsis
Nach schwerem Trauma findet im Organismus häufig eine überschießende Immunantwort statt, die die Funktion wichtiger Organe einschränken kann. Kommt es dabei zu einer zusätzlichen bakteriellen Infektion, kann sich durch eine Immunfehlregulation in kurzer Zeit eine lebensbedrohliche Sepsis mit Multiorganversagen entwickeln. In unserer Arbeitsgruppe untersuchen wir daher, welche Faktoren entscheidend an den immunologischen Prozessen der Sepsis beteiligt sind und inwiefern diese zur Verbesserung des klinischen Outcomes pharmakologisch beeinflusst werden können.
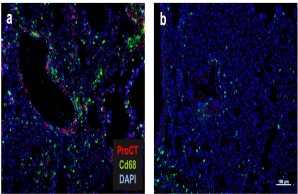
Abb.: Die Rolle von Procalcitonin in der post-traumatischen Sepsis. Der Sepsis-Biomarker Procalcitonin (ProCT) kann nicht nur für die Diagnosestellung einer bakteriellen Sepsis genutzt werden, sondern fungiert auch als pathophysiologischer Mediator in dieser Erkrankung. ProCT steigert die generalisierte Entzündungsantwort in Sepsis und führt so zu einer Gewebeschädigung, hier gezeigt in der Immunfluoreszenz von Makrophagen (Cd68) in Lungenpräparaten (a). Blockiert man Procalcitonin während der Sepsis, ist die Entzündungsreaktion und Gewebeschädigung deutlich geringer ausgeprägt (b). Modifiziert nach Baranowsky et al., Critical Care Medicine 2021.
Infektionen von Knochen und Implantaten
Bakterielle Infektionen von Knochen und osteosynthetischen Implantaten stellen seltene, aber schwerwiegende Komplikationen bei unfallchirurgischen Krankheitsbildern dar. Unsere Arbeitsgruppe untersucht daher, wie Bakterien und ihr Biofilm mit Knochen- und Knorpelzellen wechselwirken. Aus diesen Untersuchungen lassen sich beispielsweise neuartige Biomarker ableiten, die zur Diagnosestellung von peri-implantären Infektionen dienen können. Darüber hinaus können diese Untersuchungen dazu beitragen, bisherige Therapieansätze in ihrer Wirksamkeit zu verbessern. Das Projekt wird durchgeführt in enger Kooperation mit der Orthopädie, dem IOBM und der AG Rohde, Institut für Medizinische Mikrobiologie, Virologie und Hygiene, UKE.
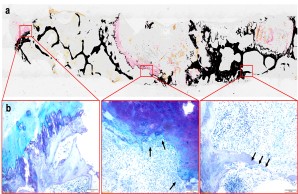
Abb.: Nichtentkalkte histologische Aufarbeitung einer bakteriellen Entzündung der Bandscheibe mit ossärer Infiltration des Wirbelkörpers. (a) Von Kossa/van Gieson-Übersichtsfärbung. (b) Detailaufnahmen in Toluidinblau-Färbung. Die Pfeile zeigen hochaktivierte Osteoklasten, die für die Destruktion der Knochensubstanz der Wirbelkörper verantwortlich sind. Gemeinschaftsprojekt mit der Orthopädie (PD Dr. Dr. Tim Rolvien), dem IOBM (Prof. Dr. Michael Amling) und der Mikrobiologie (Prof. Dr. Holger Rohde).
-
Klinisch-Translationale Forschungsschwerpunkte
Biomarker traumatischer Kniegelenkserkrankungen
Kniebinnenschäden gehören zu den häufigen Verletzungen des Bewegungsapparates, die oft junge und körperlich aktive Menschen betreffen. Hierzu zählen beispielsweise Rupturen des vorderen Kreuzbandes und Meniskusläsionen, die in unserer Klinik für Unfallchirurgie und Orthopädie auf höchstem Niveau behandelt werden. Trotz modernster therapeutischer Verfahren bleibt jedoch weiterhin unklar, wieso einzelne Patienten einen unbefriedigenden Heilungsverlauf aufweisen. Daher untersuchen wir spezielle Biomarker und molekulare Mediatoren im Kniegelenk, die prognostische Informationen über das klinische Outcome liefern und langfristig eine individualisierte Behandlung von Patienten mit Kniebinnenschäden ermöglichen sollen. Die Leitung des klinischen Anteils der Studie unterliegt PD Dr. Matthias Krause und Prof. Dr. Karl-Heinz Frosch .
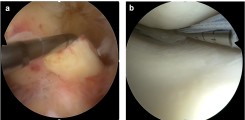
Abb.: Kniebinnentrauma als typisches Beispiel für häufige Verletzungen des Bewegungsapparats. (a) Frischer Riss des vorderen Kreuzbandes (ACL). Hier wird das ACL während der arthroskopischen Exploration mit einer Hakensonde nach vorne gezogen. (b) Arthroskopische Naht eines gerissenen Meniskus in der posteromedialen Gelenkecke.
Molekularbiologischer Footprint von Pseudarthrosen
Die ausbleibende Knochenheilung nach einer Fraktur stellt nach wie vor eine große klinische Herausforderung in der Unfallchirurgie dar, die sowohl ältere und vorerkrankte, aber auch junge und berufstätige Patienten betrifft. Demnach ist die Verbesserung der Knochenregeneration von großer klinischer Bedeutung. Basierend auf den Ergebnissen unserer Grundlagenforschung in diesem Bereich untersuchen wir klinisch die Rolle verschiedener Kandidatenproteine bei der gestörten Frakturheilung. Das übergeordnete Ziel dieser Studie ist es, unsere Erkenntnisse zur Verbesserung der Knochenregeneration bei allen Patienten mit gestörter Knochenheilung anwenden zu können. Die Leitung des klinischen Anteils der Studie unterliegt Dr. Holger Kleinertz und Dr. Carsten Schlickewei .
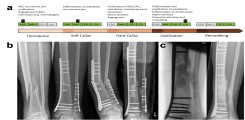
Abb.: Frakturheilung. (a) Verlauf regelhafter Frakturheilung und involvierte Wachstumshormone. (b) Fallbeispiel mit verzögerter Frakturheilung und peri-implantärer Fraktur. (c) Ausheilung nach mehrstufiger Therapie mittels Masquelet-Technik und Knochen-Graft mit autologer Spongiosa. Modifiziert nach Schlickewei, Kleinertz et al., IJMS 2019.
Strukturmorphologische und molekulare Analyse heterotoper Ossifikationen
Die ektope Knochenbildung (heterotope Ossifikation) nach einem Trauma führt insbesondere im Ellenbogen- und Hüftgelenk zu nachhaltigen Funktionseinschränkungen, beginnend mit verminderter Beweglichkeit, der Kompression von Nerven- und Gefäßen, sowie erforderlichen Revisionsoperationen. In unserer Arbeit untersuchen wir strukturelle, zelluläre und molekulare Mechanismen, die zum Auftreten und Fortschreiten dieser Erkrankung beitragen. Die Leitung des klinischen Anteils der Studie erfolgt durch Dr. Milad Fal und PD Dr. Konrad Mader .
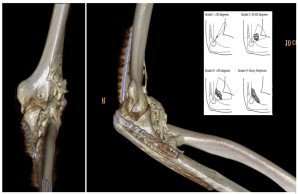
Abb.: 3D-gerendertes CT des linken Ellenbogen bei einem 25-jährigen Mann mit Komplextrauma des Ellenbogens. Post-traumatisch kommt es zur Bildung einer massiven heterotopen Ossifikation (HO) ventral und radial in den Weichteilen. Im Insert eine Schemazeichnung zur Erläuterung der Klassifikation der HO am Ellenbogen nach Ilahi.
3D-Druck von Knochen und Gelenken für die Anwendung in Klinik, Forschung, und Lehre
Der 3-D-Druck wird in der modernen Universitätsmedizin immer wichtiger. Besonders in der Unfallchirurgie erlebt der 3D-Druck in der Diagnostik, Planung und Versorgung von Frakturen und komplexen Rekonstruktionseingriffen einen technologischen Aufschwung. Mit unserer Forschung explorieren wir verschiedene Anwendungsgebiete des 3D-Drucks in der Traumatologie, um langfristig die Implementierung dieser Technik in individualisierten Therapiekonzepten zu ermöglichen. Die Betreuung unserer Projekte zum 3D-Druck unterliegt Dr. Tobias Dust und PD Dr. Konrad Mader .
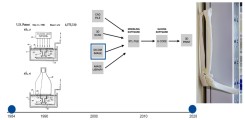
Abb.: Evolution des medizinischen 3D-Drucks: links die Original-Patentzeichnung von Chuck Hall aus dem Jahre 1986, in der Mitte der Prozess vom Bilddatensatz zum 3D-Druck, und rechts ein 3D-Ausdruck eines CT-Datensatzes eines Patienten mit komplexer (Transolekranon-) Luxationsfraktur des rechten Ellbogens.
-
Ausgewählte Publikationen
Jiang, S., Xie, W., Knapstein, P. R., Donat, A., Albertsen, L.-C., Sevecke, J., Erdmann, C., Appelt, J., Fuchs, M., Hildebrandt, A., Maleitzke, T., Frosch, K.-H., Baranowsky, A., & Keller, J. (2024). Transcript-dependent effects of the CALCA gene on the progression of post-traumatic osteoarthritis in mice. Communications Biology, 7(1), 223. https://doi.org/10.1038/s42003-024-05889-0
Xie, W., Jiang, S., Donat, A., Knapstein, P. R., Albertsen, L.-C., Kokot, J. L., Erdmann, C., Rolvien, T., Frosch, K.-H., Baranowsky, A., & Keller, J. (2024). Tranexamic Acid Attenuates the Progression of Posttraumatic Osteoarthritis in Mice. The American Journal of Sports Medicine, 52(3), 766–778. https://doi.org/10.1177/03635465231220855
Jahn, D., Knapstein, P. R., Otto, E., Köhli, P., Sevecke, J., Graef, F., Graffmann, C., Fuchs, M., Jiang, S., Rickert, M., Erdmann, C., Appelt, J., Revend, L., Küttner, Q., Witte, J., Rahmani, A., Duda, G., Xie, W., Donat, A., … Keller, J. (2024). Increased β2-adrenergic signaling promotes fracture healing through callus neovascularization in mice. Science Translational Medicine, 16(743), eadk9129. https://doi.org/10.1126/scitranslmed.adk9129
Messerer, D. A. C., Datzmann, T., Baranowsky, A., Peschel, L., Hoffmann, A., Gröger, M., Amling, M., Wepler, M., Nussbaum, B. L., Jiang, S., Knapstein, P., Donat, A., Calzia, E., Radermacher, P., & Keller, J. (2022). Systemic calcitonin gene-related peptide receptor antagonism decreases survival in a porcine model of polymicrobial sepsis. BRIT J ANAESTH, 128(5), 864-873.
https://doi.org/10.1016/j.bja.2021.11.042Grewe, J. M., Knapstein, P-R., Donat, A., Jiang, S., Smit, D. J., Xie, W., & Keller, J. (2022). The role of sphingosine-1-phosphate in bone remodeling and osteoporosis. BONE RES, 10(1), [34].
https://doi.org/10.1038/s41413-022-00205-0Baranowsky, A., Jahn, D., Jiang, S., Yorgan, T., Ludewig, P., Appelt, J., Albrecht, K. K., Otto, E., Knapstein, P., Donat, A., Winneberger, J., Rosenthal, L., Köhli, P., Erdmann, C., Fuchs, M., Frosch, K-H., Tsitsilonis, S., Amling, M., Schinke, T., & Keller, J. (2022). Procalcitonin is expressed in osteoblasts and limits bone resorption through inhibition of macrophage migration during intermittent PTH treatment. BONE RES, 10(1), [9].
https://doi.org/10.1038/s41413-021-00172-yMaleitzke, T., Hildebrandt, A., Weber, J., Dietrich, T., Appelt, J., Jahn, D., Zocholl, D., Baranowsky, A., Duda, G. N., Tsitsilonis, S., & Keller, J. (2021). Proinflammatory and bone protective role of calcitonin gene-related peptide alpha in collagen antibody-induced arthritis. RHEUMATOLOGY, 60(4), 1996-2009.
https://doi.org/10.1093/rheumatology/keaa711Baranowsky, A., Appelt, J., Kleber, C., Lange, T., Ludewig, P., Jahn, D., Pandey, P., Keller, D., Rose, T., Schetler, D., Braumüller, S., Huber-Lang, M., Tsitsilonis, S., Yorgan, T. A., Frosch, K-H., Amling, M., Schinke, T., & Keller, J. (2021). Procalcitonin Exerts a Mediator Role in Septic Shock Through the Calcitonin Gene-Related Peptide Receptor. CRIT CARE MED, 49(1), e41-e52.
https://doi.org/10.1097/CCM.0000000000004731Appelt, J., Baranowsky, A., Jahn, D., Yorgan, T. A., Köhli, P., Otto, E., Farahani, S. K., Graef, F., Fuchs, M., Herrera, A., Amling, M., Schinke, T., Frosch, K-H., Duda, G. N., Tsitsilonis, S., & Keller, J. (2020). The neuropeptide calcitonin gene-related peptide alpha is essential for bone healing. EBIOMEDICINE, 59, 102970.
https://doi.org/10.1016/j.ebiom.2020.102970Keller, J., Catala-Lehnen, P., Hübner, A. K., Jeschke, A., Heckt, T., Lueth, A., Krause, M., Koehne, T., Albers, J., Schulze, J., Schilling, S., Haberland, M., Denninger, H., Neven, M., Hermans-Borgmeyer, I., Streichert, T., Breer, S., Barvencik, F., Levkau, B., ... Amling, M. (2014). Calcitonin controls bone formation by inhibiting the release of sphingosine 1-phosphate from osteoclasts. NAT COMMUN, 5, 5215.
https://doi.org/10.1038/ncomms6215Albers, J.*, Keller, J.*, Baranowsky, A.*, Beil, F. T., Catala-Lehnen, P., Schulze, J., Amling, M., & Schinke, T. (2013). Canonical Wnt signaling inhibits osteoclastogenesis independent of osteoprotegerin. J CELL BIOL, 200(4), 537-49. *equal contribution.
https://doi.org/10.1083/jcb.201207142 -
Förderung
Deutsche Forschungsgemeinschaft
Else-Kröner-Fresenius-Stiftung
Clinician Scientist Programm UKE
Mildred-Scheel Nachwuchszentrum
Berlin Institute of Health
Charité 3R
Jung-Stiftung
Wir bedanken uns sehr herzlich bei allen Förderinstitutionen für die Unterstützung unserer Arbeit.
-
Promotions- und Studienarbeiten
Die Experimentelle Unfallchirurgie bietet interessierten Studierenden anspruchsvolle Promotions- und Studienarbeiten an. Die Begeisterung für Unfallchirurgie, größtes Engagement, kreative und problemorientierte Denkweise sowie die Fähigkeit zum eigenverantwortlichen Arbeiten sind essenzielle Voraussetzungen. Erst- und Co-Autorschaft bei Publikationen und Beiträgen auf nationalen und internationalen Fachkongressen werden, nach Möglichkeit, für alle Studierende und Promovierende angestrebt.
Wir bitten um Verständnis, dass zur Sicherstellung einer hochqualitativen Betreuung nur eine begrenzte Auswahl an geeigneten Kandidaten berücksichtigt werden kann.
Bei Interesse freuen wir uns über Ihre Nachricht an: j.keller@uke.de