Dr. rer. nat. Christian Gorzelanny (Laborleiter)
Dr. sc. hum. Alexander T. Bauer (Arbeitsgruppenleiter)
Prof. Dr. rer. nat. Johanna M. Brandner (Arbeitsgruppenleiterin)
Dr. med. Volker Huck (Arbeitsgruppenleiter, Forschungskoordinator)
Dr. rer. nat. Kathrein von Kopylow (Arbeitsgruppenleiterin)
Dipl.-Inf. Christian Meß (Arbeitsgruppenleiter)
PD Dr. rer. nat. Maria A. Brehm (
Gastwissenschaftlerin, Universität Siegen
)
Forschungsprojekte
Entzündung, Gerinnung und Metastasierung – Die Rolle des Endothels
-
Entzündung, Gerinnung und Metastasierung – Die Rolle des Endothels
Ausgehend von der Barriere zwischen Blutstrom und Gewebe, dem Endothel, steht im Zentrum des Forschungsprojektes die Untersuchung der aktiven Rolle der gefäßauskleidenden Zellen im wechselseitigen Zusammenspiel der Prozesse Entzündung, Gerinnung und Metastasierung.
Das vaskuläre Endothel, das unter physiologischen Bedingungen den Blutfluss aufrechterhält, kann durch verschiedenste Stimulantien, zirkulierende Blutzellen, pathophysiologische Bedingungen und auch maligne Tumorzellen aktiviert werden.Diese Endothelzellaktivierung hat eine unmittelbare Exozytose von Weibel Palade-Körperchen (Weibel Palade bodies, WPB), langgestreckten Vesikeln im Zytoplasma, zur luminalen Seite zur Folge. Dadurch kommt es innerhalb weniger Sekunden zu einem Wechsel von einem primär antientzündlichen, gerinnungshemmenden in einen proinflammatorischen, prokoagulatorischen Zustand des betroffenen Endothelbereiches. In den WPB ist neben einer Vielzahl von Mediatoren der Entzündung, wie beispielsweise P-Selektin, Interleukin-8, Osteoprotegerin und Eotaxin-3, auch der von Willebrand-Faktor (VWF) als zentrales Protein der Blutgerinnung kolokalisiert. Diese Aktivierung, die mit der Sekretion des im Blutfluss netzartig gestreckten Proteins VWF auf der Endotheloberfläche einhergeht, steht im Fokus der folgend aufgeführten Projekte
.
-
Interzelluläre Kommunikation zwischen Tumorzellen und Endothelzellen
Maligne Zellen besitzen die Fähigkeit, sich via Lymph- und Blutgefäßsystem auszubreiten und Metastasen zu bilden. In diesem Zusammenhang konnten wir zeigen, dass Tumor-aktiviertes Endothel VWF-Fäden freisetzt.
Um dem Zugriff des menschlichen Immunsystems im tumoriziden Blutstrom zu entgehen, ist eine möglichst frühzeitige Kontaktaufnahme mit der Gefäßwand notwendig; erst die Adhäsion am Endothel unter Überwindung der im Gefäßsystem herrschenden Scherkräfte ermöglicht die Auswanderung in das umliegende Gewebe (Extravasation). Diesem Prozess liegt ein komplexes Wechselspiel von zellulären Interaktionen zwischen der im Blut zirkulierenden Tumorzelle und dem Gefäßendothel zu Grunde.Die im Zentrum dieses Teilprojektes stehende Hypothese lautet: Die Expression und/oder Sekretion proinvasiver Moleküle durch maligne Zellen führt zur Aktivierung der Endothelzellen und induziert somit die Freisetzung des unter Fluss hoch adhäsiven VWF. Vor diesem Hintergrund untersuchen wir die molekularbiologischen Wirkmechanismen dieser interzellulären Kommunikation. Aus einem präzisen Verständnis der molekularen Pathophysiologie dieses Prozesses erhoffen wir, gezielt Angriffsstellen zur therapeutischen Interferenz an dieser Stelle der Metastasierungskaskade identifizieren zu können. Basis unserer Untersuchungen sind neben artifiziellen Blutgefäßen, welche die Mikrozirkulation des menschlichen Körpers in vitro nachstellen, auch verschiedene murine Tumormodelle. Durch eine intradermale Inokulation von Tumorzellen werden definierte Tumore in der Haut generiert, welche spezifisch Metastasen in den umliegenden Lymphknoten ausbilden. Den hämatogenen Metastasierungsweg mit Ausbildung von Organmetastasen induzieren wir durch die intravenöse Injektion von Tumorzellen.
Neben den experimentellen Tumormodellen stehen uns transgene Mausmodelle mit spontaner Tumorentstehung und Metastesen in Lymphknoten, Lunge und Gehirn zur Verfügung, welche ein realistisches Metastasierungsmuster, wie es auch im betroffenen Patienten auftritt, aufweisen.
Zusammengenommen reflektieren diese Modelle das Metastasierungsverhalten vieler humaner Krebserkrankungen und ermöglichen durch Implementierung immunhistologischer Untersuchungen, sowie durch Proteom- und Transkriptomanaylsen, die Untersuchung zugrundeliegender Mechanismen. Durch die enge Anbindung an die Klinik stehen uns sowohl Gewebe- als auch Blutproben diverser Patienten zur Verfügung, welche zur Validierung unserer Befunde sehr wertvoll sind. -
Extravasation und Metastasierung - Tumor-Endothel-Interaktion im Blutstrom
Das Adhäsions- und Migrationsverhalten von Tumorzellen auf aktiviertem Endothel und die beiderseitigen Wechselwirkungen mit VWF unter Flussbedingungen stehen im Zentrum dieses Teilprojektes. Die exakt quantifizierbare Simulation der physikalischen Bedingungen im Mikromilieu der tumoraktivierten Endothelzellen ist hierbei von besonderer Bedeutung. Zur Kultivierung der Endothelzellen unter Flussbedingungen und direkten Beobachtung der Tumor-Endothel-Interaktion kommen verschiedene Flusskammersysteme zum Einsatz. In diesen „künstlichen Blutgefäßen“ sind zudem spezielle und pathophysiologische Strömungsbedingungen (Stenosen, Bifurkationen, turbulente Strömungen) simulierbar.
Ein direktes Live Cell Imaging Imaging unter Verwendung hochauflösender Mikroskopiemethoden wie der diferentiellen Interferenzkontrastmikroskopie (DIC), der Reflexions-Interferenz-Kontrastmikroskopie (RICM) und fluoreszenzmikroskopischer Verfahren erlaubt eine Analyse der Wechselwirkungen auch unter Verwendung von Patientenvollblut. -
Adhäsionsverhalten von Thrombozyten und Leukozyten am aktivierten Endothel
Neben Verletzungen des Endothelrasens mit Exposition der extrazellulären Matrix als bekanntem Aktivator der Blutgerinnung führen auch inflammatorische Prozesse zu prokoagulatorischer Veränderung des intakten Endothels; der an der luminalen Oberfläche der Endothelzellen dem Blutstrom exponierte, hoch adhäsive VWF begünstigt die Anhaftung von Blutzellen, Pathogenen und malignen Zellen.
Im Fokus dieses Teilprojektes steht die VWF-vermittelte Wechselwirkung von Blutzellen, insbesondere Thrombozyten und Leukozyten, mit dem aktivierten Endothel. Hierzu werden im in vitro Gefäßsystem funktionalisierte Oberflächenbeschichtungen mit Blutproben von Patienten unter definierten Flussbedingungen überströmt und mikroskopisch hinsichtlich Ihres Adhäsionsverhaltens charakterisiert. Als Oberflächenbeschichtung kommen dabei verschiedene Bestandteile der extrazellulären Matrix, VWF und vollständige Endothelrasen zum Einsatz, so dass, teils unter Zugabe spezifischer Inhibitoren einzelner bekannter Adhäsionsmoleküle, ein krankheitsspezifisches Adhäsionsprofil ermittelt werden kann. Die RICM gewährleistet zudem eine native Beobachtung der Thrombozytenadhäsion sowie der Leukozytenmigration in Echtzeit; dieses experimentelle Setup eröffnet damit die Möglichkeit zur spezifischen Analyse der beteiligten Bindungsstellen und der zu Grunde liegenden physiologischen Parameter der Thrombozyten/Leukozyten-Endothel-Interaktion.Auf der beschichteten mit Patientenblut überströmten Oberfläche lagern sich mehr und mehr Thrombozyten an, sie schichten sich übereinander. Nach fünf Minuten ist ein Rolling von Leukozyten über dem Thrombozytenlayer zu beobachten. (A: Beschichtungsebene, B: 10 µm oberhalb der Beschichtungsebene)
Leukozytenmigration am Endothel im Vollblut; RICM
Aus dem überströmenden Patientenblut werden Leukozyten rekrutiert, die auf der Oberfläche zu wandern beginnen. Die Migrationsrichtung ist unabhängig von der Richtung der rasanten Blutströmung.
Nanotechnologie, Biophotonik und Künstliche Intelligenz
-
Biologische und toxische Effekte von Nanopartikeln
Angesichts vielversprechender klinischer Möglichkeiten der Nanotechnologie müssen auch potentielle Expositionsrisiken für Mensch und Umwelt sorgfältig überprüft werden. Natürlich vorkommende und synthetische Nanopartikel gelangen primär per inhalationem, aber auch über den Gastrointestinaltrakt und die Haut durch Endothelzellen der Kapillaren in den menschlichen Blutkreislauf. Trotz verschiedener toxikologischer Studien bleibt das Gefährdungspotential so aufgenommener Nanopartikel weitgehend ungeklärt. Ziel dieses Teilprojektes ist es daher, die Wechselwirkungen für den Menschen relevanter Silica- und Eisenoxid Partikel mit definierten Eigenschaften, wie Durchmesser und Oberflächenbeschichtung, mit dem vaskulären Endothel eingehend zu studieren. Dies beinhaltet Untersuchungen der Auswirkungen auf die biologische Funktionalität, zelluläre Signaltransduktion, Induktion von Inflammationsreaktionen und auf das koagulatorische System. Methodisch stehen dabei standardisierte Zytotoxizitätstests und molekularbiologische sowie zellbiologische Assays an einem etablierten in vitro Modell, basierend auf humanen Endothelzellen (HUVECs), im Mittelpunkt. Ferner wird die Aufnahme, subzelluläre Lokalisation und Prozessierung fluoreszenzmarkierter Nanopartikel durch Konfokalmikroskopie und hochauflösende mikroskopische Verfahren wie der Rasterkraftmikroskopie (AFM) ermittelt.
Biologische Effekte von therapeutisch nutzbaren Nanopartikeln für die Krebstherapie werden neben den in vitro Versuchen auch in murinen Modellen direkt mit in vivo Experimenten validiert. Neben makroskopischen Größen wie dem Tumorwachstum und der Metastasierung in Lymphknoten, Lunge und Gehirn, welche wir immunhistologisch aufarbeiten, verwenden wir ebenfalls verschiedene Verfahren der intravitalen Bildgebung um die Biodistribution von Nanopartikeln im Organismus und die therapeutische Anreicherung im Tumor visuell nachzuweisen. -
Inflammatorische Hauterkrankungen im Lichte der Nanotechnologie
Die atopische Dermatitis ist eine entzündliche Erkrankung der Haut. Obwohl die Ursachen der Krankheitsentstehung sehr komplex sind, wird davon ausgegangen, dass die Beeinträchtigung der physikalischen Hautbarriere maßgeblich den Krankheitsverlauf bestimmt. Die physikalische Barriere ist im Wesentlichen der obersten Hautschicht, der Epidermis, zugeordnet. Die Epidermis wird hauptsächlich aus Keratinozyten gebildet, welche im Verlauf ihrer Differenzierung eine Vielzahl von Molekülen produzieren, die eine Schlüsselrolle in der Bildung der physikalischen Hautbarriere übernehmen. Ist die Produktion einzelner Barrierekomponenten gestört kommt es zu vermehrter Penetration pathogener und allergener Substanzen, was zu einer kontinuierlichen Aktivierung des Immunsystems und somit zu einer chronischen Entzündungsreaktion der Haut führt. Neusten Erkenntnissen zur Folge tritt bei einem großen Protzentsatz der Erkrankten eine Mutation innerhalb des Filaggrin-Gens auf; des Weiteren scheint auch eine beeinträchtigte Synthese von Hautlipiden ursächlich an der Krankheitsentstehung beteiligt zu sein.
Zur Verbesserung der gegenwärtigen Therapieoptionen streben wir eine detaillierte morphologische und funktionelle Charakterisierung der Epidermis an. Zur nicht-invasiven Untersuchung entzündlicher Hautzustände am Patienten konnten in der Vergangenheit zwei vielversprechende Methoden der Nanotechnologie in unserem Labor zur Untersuchung der menschlichen Haut etabliert werden, die Rasterkraftmikroskopie und die Multiphotonentomographie. -
Künstliche Intelligenz, Big Data und automatische Bildverarbeitung
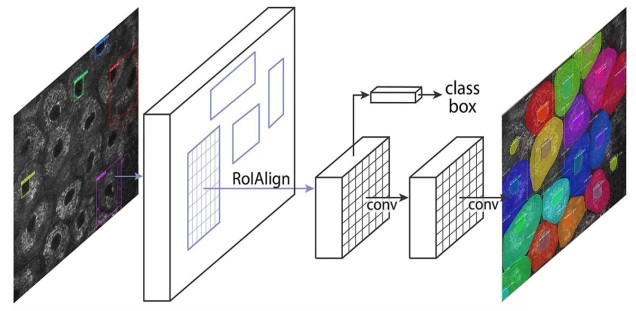
Moderne automatisierte Mikroskopie- und Analyse-Methoden erzeugen immer größere Datenmengen und eine manuelle Auswertung dieser Daten wird dadurch zunehmend schwieriger. Weiter existieren bereits große Mengen an Daten aus der klinischen Forschung und die Zusammenführung und Nutzbarmachung dieser Daten ist eine weitere Herausforderung.
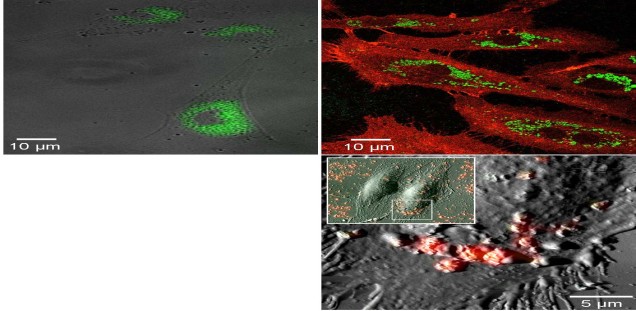
Techniken aus den Bereichen der Bildverarbeitung und Bildanalyse helfen bei der automatisierten Analyse von Mikroskopie-Daten. Oft liegen diese Daten aber, bedingt durch die verwendeten Aufnahmetechniken, in suboptimaler Qualität vor, so dass herkömmliche Algorithmen fehlschlagen. Hier ist ein Einsatzgebiet der Künstlichen Intelligenz. Beispielsweise kann ein Neuronales Netz mit von Experten annotierten Daten soweit trainiert werden, dass das Netz danach die Analyse autonom in guter Qualität durchführen kann. Ein Beispiel hierfür ist die automatische Segmentierung von humanen Keratinozyten innerhalb von in vivo Aufnahmen aus der Multiphotonen-Mikroskopie (siehe Abbildung).
Wundheilung
-
Die Rolle von Tight Junctions in der Wundheilung
Die Wundheilung ist ein komplexer Prozess, der in drei einander überlappenden Phasen verläuft:
1) Entzündungsphase (Abwehr)
2) Regenerationsphase (Gewebewachstum)
3) Remodellierungsphase (Narbenbildung)Die erste Phase dient dem akuten Verschluss durch Koagulation, der Reinigung der Wunde, der Bildung einer provisorischen Matrix und dem Start der Wundregeneration. Dies wird erreicht durch die Aktivierung von Blutplättchen und Blutgerinnungsfaktoren, durch das Einwandern von Makrophagen und Neutrophilen und die Abgabe von reaktiven Sauerstoffspezies sowie durch das Ausschütten von proinflammatorischen Cytokinen und Wachstumsfaktoren.
In der zweiten Phase regenerieren sich sowohl Dermis als auch Epidermis durch Proliferation und Migration von Keratinozyten und Fibroblasten, dem Wachstum von neuen Blutgefäßen und der Bildung von extrazellulärer Matrix. In dieser Phase wird die Wunde durch Granulationsgewebe aufgefüllt und durch ein neues Epithel und damit einer provisorischen Barriere verschlossen.
Die dritte Phase dient der weitgehend vollständigen Wiederherstellung der Funktionalität der Haut (Barrierefunktion, Reißfestigkeit, Sensitivität). Sie ist gekennzeichnet durch einen Umbau der extrazellulären Matrix, der Verminderung von Myofibroblasten und Blutgefäßen durch Apoptose und der Atrophie der hypertrophen Epidermis. Normalerweise führt die Remodellierung zu einer mehr oder weniger ausgeprägten Narbe.
Geraten diese stark kontrollierten und gut aufeinander abgestimmten Vorgänge aus dem Gleichgewicht, entstehen chronische Wunden. Von einer chronischen Wunde spricht man, wenn diese nicht innerhalb von 4-12 Wochen Heilungstendenzen zeigt, obwohl sie lege artis behandelt wurde. Ursachen für chronische Wunden sind venöse oder arterielle Gefäßerkrankungen (z.B. Ulcus cruris venosum), metabolische Erkrankungen wie Diabetes mellitus (z.B. diabetisches Fußsyndrom), eine falsche Lagerung des Körpers (Dekubitus, Ulcus) sowie immunologische Erkrankungen (z.B. Pyoderma gangränosum). Darüber hinaus können Infektionen ursächlich oder verstärkend für chronische Wunden sein.
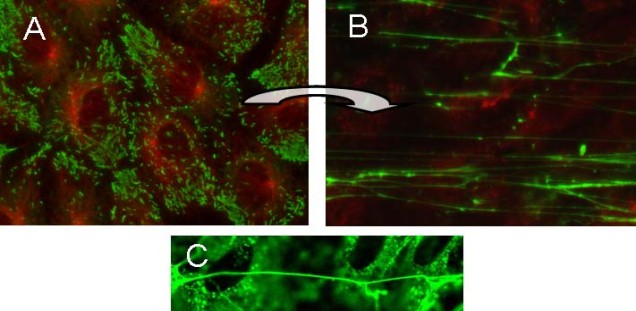
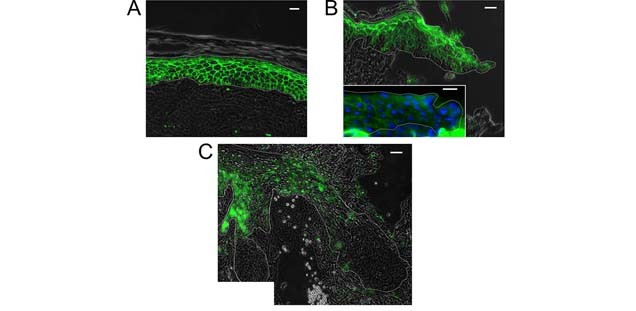
Wir interessieren uns besonders für die Rolle von Tight Junctions (TJ) in der Wundheilung und konnten die Bedeutung von TJ Proteinen während der Wundheilung zeigen [s. Abb. Die Rolle von Tight Junctions in der Wundheilung.jpg].
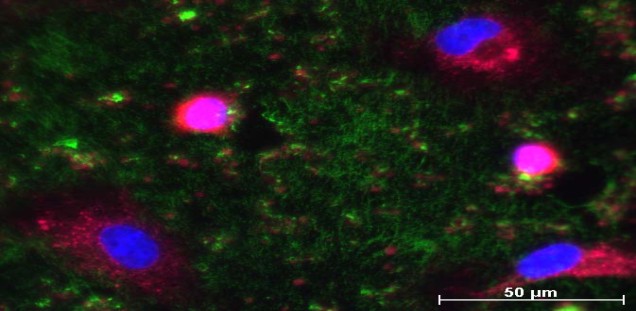
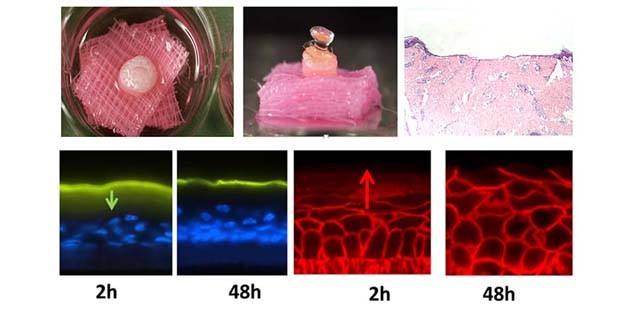
Darüber hinaus ist ein Schwerpunkt unserer Arbeit die Entwicklung von Wundheilungsmodellen (porcine und humane ex vivo Wundheilungsmodelle für flache und tiefe Wunden, diabetische Wunden und infizierte Wunden) [s. Abb. Wundmodelle] zur Untersuchung von Grundlagen der Wundheilung aber auch zur Testung der wundheilungsfördernden und barrierestärkenden Wirkung von verschiedenen Substanzen, Formulierungen und Wundauflagen.
-
Biophotonische Untersuchung von Wundheilungsstörungen am Patienten
Akute und chronische Wunden stellen eine der zentralen Herausforderungen in der Medizin dar. Der beschriebene pathophysiologische Stadienverlauf der Wundheilung ist äußerst komplex und verlangt eine permanente Adaptation der Wundtherapie. Eine subzelluläre Detektion dieser Stadien und deren Charakterisierung in vivo bietet die Möglichkeit, von den gewonnenen Erkenntnissen in vitro und ex vivo zu profitieren und auch direkt am Patienten die molekularen Hintergründe des Wundheilungsprozesses nicht-invasiv zu beleuchten. Beispielsweise kann die Wundheilung durch eine kontinuierliche Aktivierung des Immunsystems mit konsekutiver Sekretion von Matrix-Metalloproteasen verzögert werden und somit chronifizieren. Im Rahmen dieses Forschungsprojektes werden die Grundlagen für die Nutzung der Multiphotonentomographie zur in vivo Diagnostik akuter und chronischer Wunden erarbeitet.
Diese Untersuchungstechnik ermöglicht, alle Phasen der Wundheilung im Verlauf auf zellularer Ebene zu untersuchen und somit einen Einblick in die Pathophysiologie der Wunde zur erhalten. Die Untersuchung erfolgt intravital, also direkt am Patienten, so dass die Entnahme von Gewebeproben vermieden und wiederholte Messungen während der gesamten therapeutischen Behandlung nicht-invasiv durchgeführt werden können.Ziel dieser klinischen Studie ist es, bei Patienten mit chronischen Wunden den Zustand der Wunde zu erfassen und unter Therapie zu beobachten. Auf dieser Grundlage wird ein Konzept zur gezielten individualisierten stadienabhängigen Therapie entwickelt.
Barrierefunktion der Haut
-
Barrierefunktion der Haut - Einleitung
Die Haut ist eine essentielle Barriere für unseren Körper. Sie verhindert das Eindringen von Pathogenen, Allergenen und sonstigen Fremdstoffen sowie den Verlust von Wasser, Ionen und Nährstoffen.
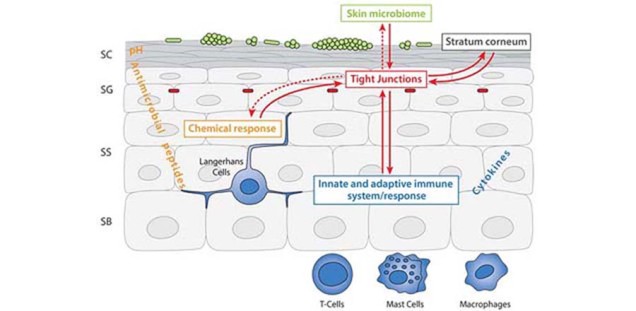
Die Hautbarriere setzt sich aus verschiedenen Komponenten zusammen: den mechanischen Barrieren des Stratum corneums und der Tight Junctions (TJs), der Mikrobiom-Barriere, der immunologischen Barriere bestehend aus Immunzellen und Cytokinen und der chemischen Barriere bestehend aus antimikrobiellen Peptiden. Diese Barrieren stehen in Interaktion miteinander, die Veränderung einer Komponente führt zur Reaktion der anderen Komponenten. -
Die Rolle von Tight Junctions in der Hautbarrierefunktion, Interaktion mit verschiedenen Komponenten der Hautbarriere sowie Infektionen
Im Zentrum unseres Interesses liegen die TJs und ihre Interaktion mit den anderen Hautbarrieren. TJs sind Zell-Zellverbindungen, die im Stratum granulosum eine Barriere ausbilden. Der Verlust des TJ Proteins Claudin-1 führt in Mäusen am ersten Tag nach Geburt zum Tod aufgrund von starker Dehydratation über die Haut. TJs werden sowohl in der interfollikulären Epidermis, als auch im Haarfollikel gefunden. Ihr Aufbau ist äußerst komplex mit einer Vielzahl von Transmembran- und Plaque Proteinen, die zum einen die Dichtigkeit der TJs bestimmen und regulieren, zum anderen Signale in die Zelle weiterleiten und somit am “cell signaling“ beteiligt sind. Wir und andere konnten in den letzten Jahren zeigen, dass TJs mit dem Stratum corneum, dem Mikrobiom, der immunologischen Barriere und den antimikrobiellen Peptiden interagieren [s. Abb TJ_und_Stratum_corneum_1]. Darüber hinaus spielen TJ-Proteine eine Rolle in Differenzierung, Proliferation, Migration, Apoptose und Zell-Zell-Adhäsion von Keratinozyten. Diese Funktionen werden, zumindest zum Teil, von TJ-Proteinen außerhalb von TJ-Strukturen vermittelt, sind also TJ-Struktur-unabhängig.
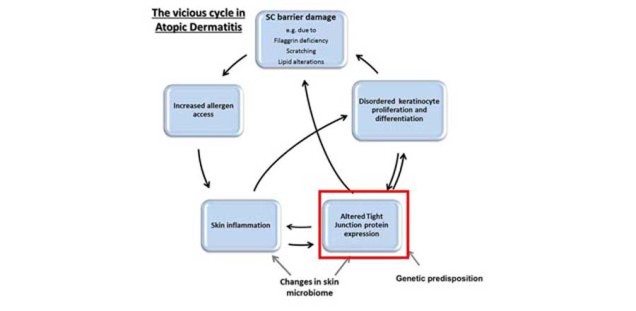
Die Hautbarriere spielt eine wichtige Rolle bei Erkrankungen. Es ist mittlerweile beispielsweise bekannt, dass bei der Atopischen Dermatitis (Neurodermitis) ein Hautbarrieredefekt, der verschiedene Ursachen haben kann, zu einem Teufelskreis der Erkrankung führt: Das Eindringen von Allergenen und die Besiedelung/Infektion mit Pathogenen aufgrund der verminderten Barrierefunktion führt zu einer (überschießenden) Reaktion des Immunsystems mit einer kutanen Entzündung, die wiederum zu einer weiteren Verschlechterung der Hautbarriere führt. Wir konnten zeigen, dass Tight Junctions dabei eine zentrale Rolle spielen [TJ_und_Stratum_corneum_2]. Darüber hinaus sind TJs auch in die Pathogenese bei Hautinfektionen involviert, ein Gebiet, das wir auch in Zukunft weiter vertiefen wollen
Neben des negativen Einflusses einer beeinträchtigten Hautbarriere bei Erkrankungen gibt es aber auch Situationen, in denen die Hautbarriere bewusst beeinträchtigt werden soll, nämlich bei der topischen Applikation von Arzneimitteln („drug delivery“). Ein besseres Verständnis der TJ Barriere im Speziellen und ihrer Interaktion mit anderen Barrieren wird in Zukunft helfen, Formulierungen für die topische Applikation zu optimieren
-
Entwicklung von Modellen für Hautpenetrations- und Hautpermeationsstudien
Zur Untersuchung der Rolle von TJs in der Haut und zur Testung der Penetration und Permeation von Formulierungen haben wir verschiedene Modellsysteme entwickelt (ex vivo Hautmodelle, 3D-Epidermismodelle, ex vivo Schleimhautmodelle, siehe auch Dienstleistungen .
Molekulare Andrologie
-
Entwicklung von Zellkultur-Bedingungen zur Vermehrung testikulärer Stammzellen bzw. deren Differenzierung in reife Spermatiden (in vitro-Spermatogenese)
Spermatogonien sind die frühesten Vorläufer der Spermatiden im adulten männlichen Organismus. Sie bilden die Grundlage für eine lebenslange Spermatogenese und entwickeln sich durch mitotische Proliferation und anschließende Differenzierung ausgehend von den humanen spermatogonialen Stammzellen. In der Vergangenheit haben wir diesen Zelltyp auf den verschiedenen Ebenen der Genexpression sowie bzgl. des epigenetischen Profils, u.a. auf Einzelzellniveau, charakterisiert und in diesem Zusammenhang auch eine Methode zur Isolierung von FGFR3-positiven humanen spermatogonialen Stammzellen etabliert.
Humane spermatogoniale Stammzellen, im Rahmen einer Fertilitätsprotektion gewonnen und kryokonserviert, in Zellkultur vermehrt und in den Hoden zurücktransplantiert, könnten nach einer den testikulären Stammzell-Pool auslöschenden Behandlung, z.B. Chemotherapie oder Bestrahlung, die vollständige Spermatogenese männlicher präpubertärer Patienten neu initiieren. Dieses würde eine spätere natürliche Vaterschaft ohne zusätzliche assistierte Reproduktionstechnik (ART) ermöglichen. Während beim erwachsenen Mann vor einer gonadotoxischen Therapie Spermien entnommen, eingefroren und später zur künstlichen Befruchtung eingesetzt werden können, besteht diese Option für Jungen vor der Pubertät nicht, da sie noch keine Spermien besitzen. Spermienzellen könnten jedoch durch eine in vitro-Spermatogenese (Reifung der Spermatiden aus Patienten-eigenen spermatogonialen Stammzellen in der Zellkulturschale) generiert und später für eine künstliche Befruchtung eingesetzt werden. Letztere Behandlungsoption ist ebenfalls relevant für erwachsene infertile Männer mit Meiose-Arrest und Kinderwunsch.
Obwohl alle diese therapeutischen Ansätze weltweit verfolgt werden und in ständiger Entwicklung sind, befinden sie sich zur Zeit immer noch auf einer experimentellen Ebene. Mit Hilfe verschiedener 3D-Zellkulturmodelle sowie Organ-Kultur- und Organoid-Kultur-Systemen wollen wir die Forschung auf diesem Gebiet vorantreiben.Doktoranden
Neels Lennart Aden
Emilia-Lula Kruschel
Masterstudentin Biologie
Dilara Leptin