- Forschungsgruppenleiterin
Forschungsprofile
Ziele
Wir untersuchen die Rolle von Neuroserpin, einem Serinproteaseinhibitor des Nervensystems, in der Physiologie und bei pathologischen Zuständen des Gehirns.
Die Rolle des Neuroserpins bei der Gehirnentwicklung
Neuroserpin gehört zur Serpin-Familie der Serinprotease-Inhibitoren und reguliert die proteolytische Aktivität des Plasminogenaktivators vom Gewebetyp (tPA). Neuroserpin kommt vor allem im Nervensystem vor, seine Expression ist auf Neuronen beschränkt und wird als Reaktion auf neuronale Aktivität verstärkt. Anhand von Neuroserpin-defizienten Mäusen konnten wir zeigen, dass Neuroserpin die Neurogenese während der Entwicklung reguliert. Im Hippocampus beobachteten wir bei Neuroserpin-Knockout-Mäusen einen vorzeitigen Wechsel von der Proliferation neuronaler Vorläuferzellen zur Differenzierung in reife Neuronen. Außerdem konnten wir eine regulierende Rolle von Neuroserpin bei der synaptischen Reifung nachweisen. Am Ende der "kritischen Periode" der synaptischen Reorganisation zeigte die Analyse der dendritischen Dornen in der CA1-Region des Hippocampus von Mäusen mit Neuroserpin-Mangel eine veränderte Morphologie in Richtung eines reiferen Phänotyps. Im gleichen Alter konnten wir erhöhte Proteinkonzentrationen von Aggrecan nachweisen, einem Bestandteil der extrazellulären Matrix, dessen Expression im Gehirn nach Abschluss der neuronalen Reifung den höchsten Stand erreicht. Diese Ergebnisse deuten darauf hin, dass ein Mangel an Neuroserpin zu einer verfrühten Bildung und Reifung der neuronalen Verbindungen führt. Im erwachsenen Mäusegehirn konnten wir eine regulierende Funktion von Neuroserpin für die synaptische Plastizität nachweisen. Das Fehlen von Neuroserpin führt zu einer Abnahme der synaptischen Dichte in der CA1-Region des Hippocampus und zu einer Verringerung der Langzeitpotenzierung. In Übereinstimmung mit diesem Phänotyp weisen Neuroserpin-Knockout-Mäuse Veränderungen im kognitiven, emotionalen und sozialen Verhalten auf.
Hemmende und nicht-hemmende Rolle von Neuroserpin
Die molekularen Mechanismen der Neuroserpin-Funktion sind nur teilweise verstanden. In-vitro-Experimente zeigten die Bildung von Komplexen und die Hemmung der proteolytischen Aktivität von tPA (tissue plasminogen activator), einer Serinprotease, die mit Neuroserpin kolokalisiert und in verschiedene physiologische Aspekte wie die Gehirnentwicklung und die synaptische Plastizität involviert ist. tPA-Aktivität ist im Gehirn von Mäusen, die Neuroserpin überexprimieren, reduziert. Darüber hinaus blockiert die Verabreichung von Neuroserpin die tPA-abhängige Plastizität des visuellen Kortex erwachsener Mäuse und schützt die Neuronen vor Verletzungen nach ischämischen Schlaganfällen und Krampfanfällen. Die zymographische Analyse von Neuroserpin-defizienten Gehirnen zeigte jedoch eine unveränderte tPA-Aktivität. Außerdem ist die neuroprotektive Rolle von Neuroserpin bei Ischämie-induzierten Verletzungen und seine Funktion bei der Regulierung der Zelladhäsion teilweise unabhängig von der tPA-Aktivität.
Um die hemmenden und nicht hemmenden Wirkmechanismen von Neuroserpin zu ermitteln, haben wir eine Knock-in-Maus erzeugt, bei der die hemmende Aktivität von Neuroserpin durch Mutation seiner reaktiven Mittelschleife inaktiviert ist (RM-PP-Mausmutante). Das Knock-in-Mausmodell wird nun untersucht.
Familiäre Enzephalopathie mit Neuroserpin-Einschlusskörpern (FENIB)
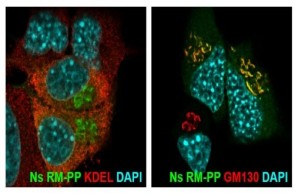
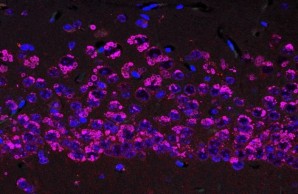
FENIB ist eine neurodegenerative Erkrankung, die durch Punktmutationen im Neuroserpin-Gen verursacht wird. Die Mutationen sind für eine Konformationsänderung des Proteins verantwortlich, die die Bildung von Neuroserpin-Polymeren begünstigt, die sich im Gehirn ansammeln und den Verlust von Nervenzellen fördern. Mithilfe von transgenen Mäusen, die das mutierte Neuroserpin-Protein überexprimieren, und einem Zellkulturmodell der Krankheit haben wir die Pathomechanismen von FENIB untersucht. Wir fanden heraus, dass sich das mutierte Neuroserpin zunehmend in neuronalen Einschlusskörpern ansammelt, und wir bestätigten, dass die Menge der Einschlüsse mit der durch die Mutation hervorgerufenen Konformationsinstabilität korreliert. Wir beobachteten eine vorübergehende Aktivierung der Ungefalteten-Protein-Reaktion und einen ER-assoziierten Abbau des mutierten Proteins in frühen Stadien der Krankheit. Obwohl der größte Teil des mutierten Proteins im endoplasmatischen Retikulum verbleibt, wird ein kleiner Teil sezerniert, der aber für die kultivierten Neurone nicht toxisch ist.
Neuroprotektive Rolle von Neuroserpin bei Schlaganfall
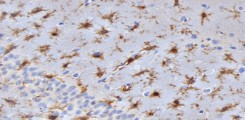
Die Verabreichung von rekombinantem Neuroserpin sowie seine transgene Überexpression verringern die Infarktgröße und die Undichtigkeit der Blut-Hirn-Schranke und erhöhen das neuronale Überleben in einem Tiermodell des ischämischen Schlaganfalls. Wir untersuchten den Ausgang des Schlaganfalls bei Neuroserpin-defizienten Mäusen und stellten eine Zunahme des Infarktvolumens und eine übermäßige Aktivierung proinflammatorischer Mikroglia fest, die durch die erhöhte Aktivität der Neuroserpin-Zielprotease tPA verursacht wird.