
Willkommen bei der AG Peter Bannas – Nanobody-basierte Theranostika!
Nanobodies sind die winzigen isolierten Bindungsdomänen kamelider Schwerekettenantikörper. Unsere Arbeitsgruppe unter der Leitung von Prof. Peter Bannas erforscht Nanobodies als diagnostische und therapeutische Werkzeuge gegen hämatologische Neoplasien. Unser Anspruch ist es, durch die Vernetzung von Radiologie, Immunologie und Onkologie innovative Lösungsansätze für die Bildgebung und Bekämpfung von Tumoren zu entwickeln.
- Team
- Forschungsthemen
- Publikationen
- Kooperationen
-
Team
Team

Prof. Dr. Peter Bannas
PI
Prof. Peter Bannas ist Leiter der AG Nanobody-basierte Theranostika und stellvertretender Direktor der Klinik und Poliklinik für Diagnostische und Interventionelle Radiologie und Nuklearmedizin.
Neben der Nanobody-basierten Bildgebung und Therapie gilt sein Interesse der quantitativen Bildgebung mittels 4D-Fluss-MRT sowie der Förderung des wissenschaftlichen Nachwuchses in der Radiologie.

Dr. rer. nat. Julia Hambach
Postdoc
Dr. Julia Hambach ist Postdoc in der AG Nanobody-basierte Theranostika sowie in der AG Nolte im Institut für Immunologie. Ihr Forschungsschwerpunkt liegt in der Entwicklung Nanobody-basierter CARs und bispezifischer Engager zur Therapie des Multiplen Myeloms.

Anna Josephine Gebhardt
BTA
Josephine Gebhardt ist die leitende Biologisch-Technische Assistentin in unserer AG. Ihr Forschungsschwerpunkt ist die Klonierung und Produktion neuer Nanobody-basierter Antikörperkonstrukte sowie die Durchführung der in vivo-Versuche.

Marten Dannenberg
BTA
Marten Dannenberg ist Biologisch-Technischer Assistent in unserer AG. Er kultiviert unsere Tumorzelllinien und führt in vivo-Bildgebungsversuche durch.

Anya Duttmann, M.Sc.
Doktorandin
Anya Duttmann ist biologische Doktorandin in der AG Bannas. Der Fokus ihrer Forschung liegt auf der Entwicklung innovativer Nanobody-basierter Schwereketten-Antikörper gegen spezifische Tumor-Antigene.

Luca Julius Pape
Doktorand
Luca Pape ist medizinischer und biologischer Doktorand in der AG Bannas. Sein Forschungsschwerpunkt ist die Erforschung von therapeutischen Antikörper-Engagern und Nanobodies für die molekulare Bildgebung des Multiplen Myeloms.

Henry Risch
Doktorand
Henry Risch ist medizinischer Doktorand in der AG Bannas. In seinem Projekt untersucht er bispezifische Nanobody-Dimere für die molekularen Bildgebung des Multiplen Myeloms.
-
-
Forschungsthemen
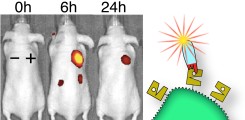
Nanobody-basierte Bildgebung
Nanobodies eignen sich aufgrund ihrer geringen Größe und guten Löslichkeit ideal für die molekulare Bildgebung von Tumoren. Durch die Kopplung an einen Nah-Infrarot-Farbstoff können die Nanobodies gut für die in vivo-Bildgebung eingesetzt werden.
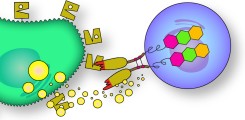
Nanobody-basierte CARs
Nanobodies lassen sich ideal in Form von chimären Antigen-Rezeptoren (CARs) in Immunzellen einbringen. Unsere bisherige Arbeit konzentriert sich auf CAR-NK- und CAR-T-Zellen, die effektiv zur Tötung CD38-positiver Myelomzellen eingesetzt werden können.
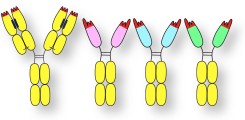
Nanobody-basierte Schwereketten-Antikörper
Wir entwickeln Nanobody-basierte Schwereketten-Antikörper zur Therapie des Multiplen Myeloms. Wir konnten zeigen, dass unsere Schwereketten-Antikörper CD38-positive Tumorzellen in vitro, ex vivo und in vivo effektiv therapieren können.
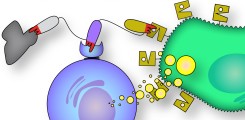
Nanobody-basierte bispezifische Engager
Nanobodies lassen sich wegen ihrer guten Löslichkeit einfach zu bispezifischen Engagern formatieren. Zur Therapie des Multiplen Myeloms arbeiten wir an Engagern, welche NK-Zellen, T-Zellen und endogene Antikörper zur Tötung von Tumorzellen anregen.
-
-
Publikationen
2024
Pape LJ, Hambach J, Bannas P. Instructions for meaningful figures in radiological research publications Rofo. 2024 May 15. English, German. doi: 10.1055/a-2285-3223. Epub ahead of print. PMID: 38749430.
2022
Hambach J, Mann AM, Bannas P, Koch-Nolte F. Targeting multiple myeloma with nanobody-based heavy chain antibodies, bispecific killer cell engagers, chimeric antigen receptors, and nanobody-displaying AAV vectors. Front Immunol. 2022 Nov 2;13:1005800. doi: 10.3389/fimmu.2022.1005800. PMID: 36405759; PMCID: PMC9668101.
Pape LJ, Hambach J, Gebhardt AJ, Rissiek B, Stähler T, Tode N, Khan C, Weisel K, Adam G, Koch-Nolte F, Bannas P. CD38-specific nanobodies allow in vivo imaging of multiple myeloma under daratumumab therapy. Front Immunol. 2022 Oct 27;13:1010270. doi: 10.3389/fimmu.2022.1010270. PMID: 36389758; PMCID: PMC9647632.
Hambach J, Fumey W, Stähler T, Gebhardt AJ, Adam G, Weisel K, Koch-Nolte F, Bannas P. Half-Life Extended Nanobody-Based CD38-Specific Bispecific Killercell Engagers Induce Killing of Multiple Myeloma Cells. Front Immunol. 2022 May 16;13:838406. doi: 10.3389/fimmu.2022.838406. PMID: 35651607; PMCID: PMC9150782.
2021
Baum N, Eggers M, Koenigsdorf J, Menzel S, Hambach J, Staehler T, Fliegert R, Kulow F, Adam G, Haag F, Bannas P, Koch-Nolte F. Mouse CD38-Specific Heavy Chain Antibodies Inhibit CD38 GDPR-Cyclase Activity and Mediate Cytotoxicity Against Tumor Cells. Front Immunol. 2021 Sep 3;12:703574. doi: 10.3389/fimmu.2021.703574. PMID: 34539634; PMCID: PMC8446682.
2020
Baum N, Fliegert R, Bauche A, Hambach J, Menzel S, Haag F, Bannas P, Koch-Nolte F. Daratumumab and Nanobody-Based Heavy Chain Antibodies Inhibit the ADPR Cyclase but not the NAD+ Hydrolase Activity of CD38-Expressing Multiple Myeloma Cells. Cancers (Basel). 2020 Dec 30;13(1):76. doi: 10.3390/cancers13010076. PMID: 33396591; PMCID: PMC7795599.
Schriewer L, Schütze K, Petry K, Hambach J, Fumey W, Koenigsdorf J, Baum N, Menzel S, Rissiek B, Riecken K, Fehse B, Röckendorf JL, Schmid J, Albrecht B, Pinnschmidt H, Ayuk F, Kröger N, Binder M, Schuch G, Hansen T, Haag F, Adam G, Koch-Nolte F, Bannas P. Nanobody-based CD38-specific heavy chain antibodies induce killing of multiple myeloma and other hematological malignancies. Theranostics. 2020 Feb 3;10(6):2645-2658. doi: 10.7150/thno.38533. PMID: 32194826; PMCID: PMC7052896.
Hambach J, Riecken K, Cichutek S, Schütze K, Albrecht B, Petry K, Röckendorf JL, Baum N, Kröger N, Hansen T, Schuch G, Haag F, Adam G, Fehse B, Bannas P, Koch-Nolte F. Targeting CD38-Expressing Multiple Myeloma and Burkitt Lymphoma Cells In Vitro with Nanobody-Based Chimeric Antigen Receptors (Nb-CARs). Cells. 2020 Jan 29;9(2):321. doi: 10.3390/cells9020321. PMID: 32013131; PMCID: PMC7072387.
2018
Schütze K, Petry K, Hambach J, Schuster N, Fumey W, Schriewer L, Röckendorf J, Menzel S, Albrecht B, Haag F, Stortelers C, Bannas P, Koch-Nolte F. CD38-Specific Biparatopic Heavy Chain Antibodies Display Potent Complement-Dependent Cytotoxicity Against Multiple Myeloma Cells. Front Immunol. 2018 Nov 19;9:2553. doi: 10.3389/fimmu.2018.02553. PMID: 30524421; PMCID: PMC6262402.
Bannas P, Koch-Nolte F. Perspectives for the Development of CD38-Specific Heavy Chain Antibodies as Therapeutics for Multiple Myeloma. Front Immunol. 2018 Nov 6;9:2559. doi: 10.3389/fimmu.2018.02559. PMID: 30459772; PMCID: PMC6232533.
2017
Bannas P, Hambach J, Koch-Nolte F. Nanobodies and Nanobody-Based Human Heavy Chain Antibodies As Antitumor Therapeutics. Front Immunol. 2017 Nov 22;8:1603. doi: 10.3389/fimmu.2017.01603. PMID: 29213270; PMCID: PMC5702627.
Fumey W, Koenigsdorf J, Kunick V, Menzel S, Schütze K, Unger M, Schriewer L, Haag F, Adam G, Oberle A, Binder M, Fliegert R, Guse A, Zhao YJ, Cheung Lee H, Malavasi F, Goldbaum F, van Hegelsom R, Stortelers C, Bannas P, Koch-Nolte F. Nanobodies effectively modulate the enzymatic activity of CD38 and allow specific imaging of CD38+ tumors in mouse models in vivo. Sci Rep. 2017 Oct 30;7(1):14289. doi: 10.1038/s41598-017-14112-6. PMID: 29084989; PMCID: PMC5662768.
2015
Bannas P, Lenz A, Kunick V, Well L, Fumey W, Rissiek B, Haag F, Schmid J, Schütze K, Eichhoff A, Trepel M, Adam G, Ittrich H, Koch-Nolte F. Molecular imaging of tumors with nanobodies and antibodies: Timing and dosage are crucial factors for improved in vivo detection. Contrast Media Mol Imaging. 2015 Sep-Oct;10(5):367-78. doi: 10.1002/cmmi.1637. Epub 2015 Apr 27. PMID: 25925493.
Bannas P, Lenz A, Kunick V, Fumey W, Rissiek B, Schmid J, Haag F, Leingärtner A, Trepel M, Adam G, Koch-Nolte F. Validation of nanobody and antibody based in vivo tumor xenograft NIRF-imaging experiments in mice using ex vivo flow cytometry and microscopy. J Vis Exp. 2015 Apr 6;(98):e52462. doi: 10.3791/52462. PMID: 25867711; PMCID: PMC4401403.
2014
Bannas P, Well L, Lenz A, Rissiek B, Haag F, Schmid J, Hochgräfe K, Trepel M, Adam G, Ittrich H, Koch-Nolte F. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 2014 Mar-Apr;9(2):135-42. doi: 10.1002/cmmi.1548. PMID: 24523058.
-
Kooperationen
Im Rahmen des THUNDER-Projekts entwickeln wir gemeinsam mit dem Universitätsklinikum Bonn neue Nanobody-basierte Theranostika. Die Vernetzung der beiden onkologischen Spitzenzentren wird von der Deutschen Krebshilfe gefördert.
-

_teaserbild.jpg)

